高二化学选择性必修1第四章:第二节电解池知识点总结
http://www.newdu.com 2025/10/26 09:10:23 三好网 佚名 参加讨论
高中化学老师给大家罗列出电解池知识点中存在的常见知识点归纳,希望可以对你的学习和复习都有所帮助,下面让我们正式开始吧!  一、电解原理 1、电解池:把电能转化为化学能的装置也叫电解槽 2、电解:电流(外加直流电)通过电解质溶液而在阴阳两极引起氧化还原反应(被动的不是自发的)的过程 3、放电:当离子到达电极时,失去或获得电子,发生氧化还原反应的过程 4、电子流向: (电源)负极—(电解池)阴极—(离子定向运动)电解质溶液—(电解池)阳极—(电源)正极 5、电极名称及反应: 阳极:与直流电源的正极相连的电极,发生氧化反应 阴极:与直流电源的负极相连的电极,发生还原反应 6、电解CuCl2溶液的电极反应: 阳极:2Cl--2e-=Cl2(氧化) 阴极:Cu2++2e-=Cu(还原) 总反应式:CuCl2=Cu+Cl2↑ 7、电解本质:电解质溶液的导电过程,就是电解质溶液的电解过程 ☆规律总结:电解反应离子方程式书写: 放电顺序: 阳离子放电顺序 Ag+>Hg2+>Fe3+>Cu2+>H+(指酸电离的)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+ 阴离子的放电顺序 是惰性电极时:S2->I->Br->Cl->OH->NO3->SO42-(等含氧酸根离子)>F-(SO32-/MnO4->OH-) 是活性电极时:电极本身溶解放电 注意先要看电极材料,是惰性电极还是活性电极,若阳极材料为活性电极(Fe、Cu)等金属,则阳极反应为电极材料失去电子,变成离子进入溶液;若为惰性材料,则根据阴阳离子的放电顺序,依据阳氧阴还的规律来书写电极反应式。 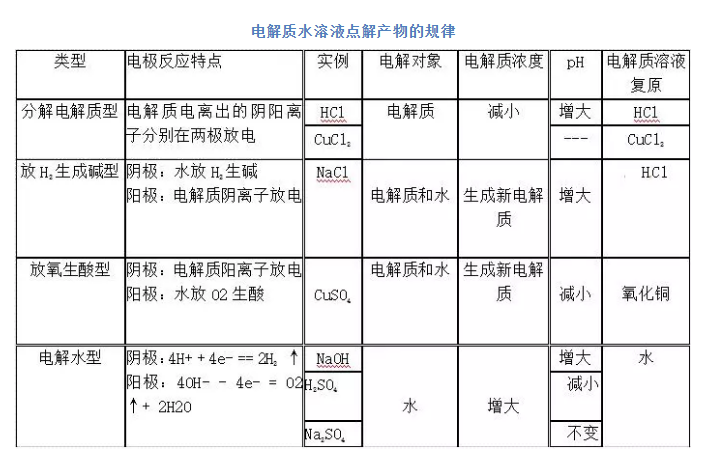 上述四种类型电解质分类: (1)电解水型:含氧酸,强碱,活泼金属含氧酸盐 (2)电解电解质型:无氧酸,不活泼金属的无氧酸盐(氟化物除外) (3)放氢生碱型:活泼金属的无氧酸盐 (4)放氧生酸型:不活泼金属的含氧酸盐 二、电解原理的应用 1、电解饱和食盐水以制造烧碱、氯气和氢气 (1)、电镀应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法 (2)、电极、电解质溶液的选择:  声明: (责任编辑:admin) |