2021年高考化学一轮复习,钠及其化合物考点详解
http://www.newdu.com 2025/11/30 10:11:29 三好网 佚名 参加讨论
为了帮助2021年高考生提高复习效率,高中化学老师给大家带来高考化学一轮复习的知识点详解,下面是有关钠及其化合物的考点详解,收藏练习吧!   例1、下列关于钠及其化合物的叙述正确的是____(填字母代号)。 ①金属钠着火,可用水扑灭 ②钠是最活泼的金属 ③用瓷坩埚灼烧Na、Na2O、NaOH等 ④电解饱和食盐水可以制得金属钠 ⑤钠投入硫酸铜溶液中,先与水反应,不能置换出铜 ⑥将一小块钠放在石棉网上,用酒精灯加热后,剧烈燃烧,产生黄色火焰,生成氧化钠 ⑦比较水与乙醇中氢的活泼性的方法是分别将少量钠投入到盛有水和乙醇的烧杯中 ⑧钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为NA ⑨23g钠与足量H2O反应完全后可生成NA个H2分子 ⑩将钠投入水中,产生气体,其化学方程式为2Na+2H2O===2NaOH+H2↑ 例1、⑤⑦⑧⑩ 【解析】金属钠与水反应生成可燃性的氢气,因此金属钠着火,不能用水扑灭,①错误;钠不是最活泼的金属,只是第三周期最活泼的金属,②错误;Na、Na2O、NaOH在空气中吸水形成碱溶液,能腐蚀瓷坩埚,③错误;电解饱和食盐水制得氢氧化钠,电解熔融氯化钠得金属钠,④错误;钠投入硫酸铜溶液中是先与水反应生成了氢氧化钠,然后氢氧化钠溶液再与硫酸铜溶液发生了复分解反应,⑤正确;钠在加热条件下与氧气反应生成过氧化钠,⑥错误;分别将少量钠投入到盛有水和乙醇的烧杯中,反应剧烈的是水,反应平缓的是乙醇,利用此反应比较水和乙醇中氢的活泼性,⑦正确;N钠在空气中燃烧可生成多种氧化物,氧化钠或过氧化钠,23g钠的物质的量是23g÷23g/mol=1mol,钠不论是转化为氧化钠,还是过氧化钠,均失去1个电子,所以钠充分燃烧时转移电子数为1NA,⑧正确;23gNa完全反应时转移电子为1mol,生成H2为0.5mol,个数为0.5NA个,⑨错误;Na性质非常活泼,可与水反应放出H2,同时生成NaOH,⑩正确。 考点二钠的氧化物 1.氧化钠与过氧化钠的比较 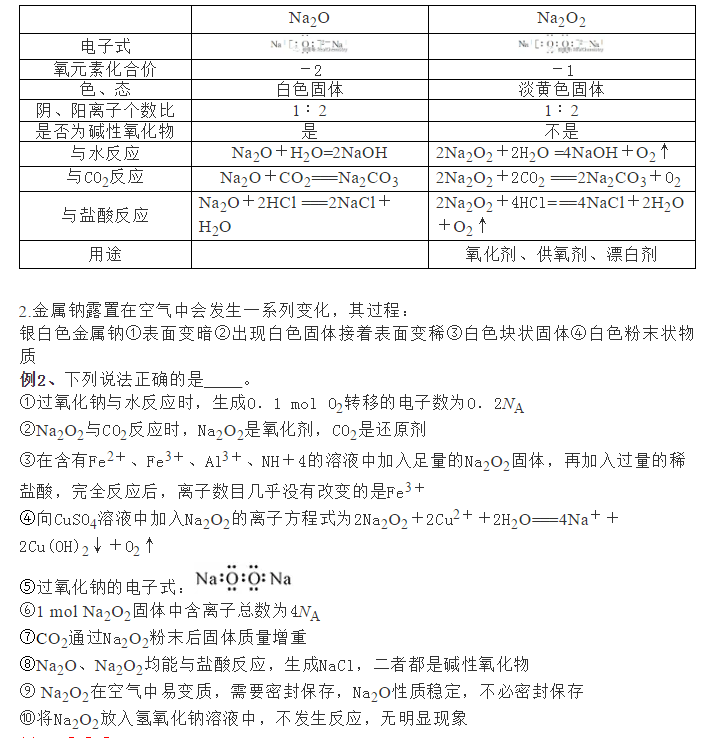   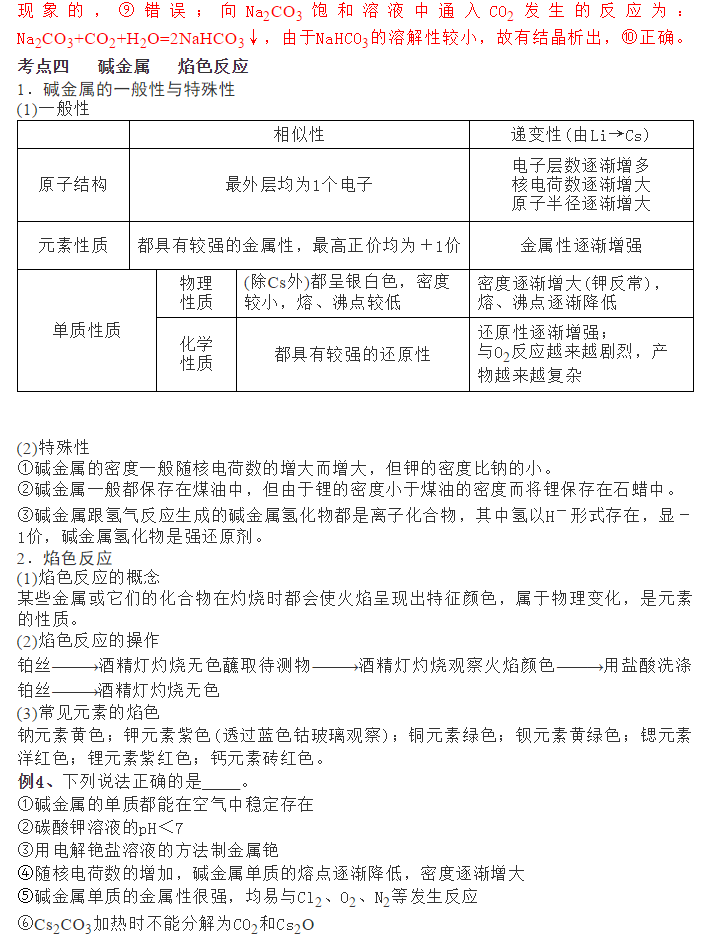       参考答案 1.D【解析】A.治疗胃酸过多要用NaHCO3而不是Na2CO3,碳酸钠的碱性较强,不能用来中和胃酸,故A错误; B.Na2O2与水反应生成氢氧化钠,向Na2O2的水溶液中滴酚酞先变红色后为无色,有因果关系,故B错误; C.常温下,金属钠在空气中生成的是氧化钠,陈述错误,故C错误; D.Na2O2能和CO2和H2O反应生成O2,可用于航天员的供氧,陈述正确,存在因果关系,故D正确. 答案选D。 2.D【解析】A.Na2O2与水反应放出氧气,Na2O2不能作气体(氧气除外)的干燥剂,故A错误; B.钠能与水剧烈反应生成氢氧化钠和氢气,钠不能从AgNO3溶液中置换出金属银,故B错误; C.钠能与水反应,所以钠着火不能用水灭火,不能用泡沫灭火器,要用沙子盖灭,故C错误; D.Na2O、Na2O2、NaOH和NaHCO3在溶于水时能完全电离,都是强电解质,故D正确; 选D。 3.D【解析】A.①中钠和氧气反应生成氧化钠,钠元素化合价升高,发生了氧化反应,故A正确; B.氢氧化钠是白色固体,②变白色是因为氧化钠和水反应生成了氢氧化钠,故B正确; C.氢氧化钠易潮解,③是氢氧化钠吸收空气中的水蒸气潮解,发生物理变化,故C正确; D.金属钠在空气中最终生成碳酸钠,④生成了碳酸钠,故D错误; 答案选D。 4.B【解析】A.实验Ⅱ中金属钠与盐酸反应,过程为金属钠失去电子生成Na+,溶液中的H+得到电子生成氢气,因盐酸中阳离子以H+占大多数,故在书写离子方程式时需要写成H+形式,选项中的离子方程式书写正确,A正确; B.从三个反应的实验现象可以看出,随着盐酸浓度的升高,反应的剧烈程度有所提高,但是在浓盐酸的溶液中Na的反应并不是很剧烈,说明随着c(H+)增大,反应的剧烈程度增大,当达到某一浓度时,反应程度会随之减弱,B错误; C.Na与水反应放热,可以将溶液中的水分子或氯化氢分子蒸出到空气中,空气温度较低使水蒸气在空气中凝结形成白雾或HCl溶在空气中的水蒸气中形成白雾,C正确; D.反应Ⅲ中盐酸浓度较高,反应一段时间后烧杯底部有白色固体生成,该白色固体为NaCl,反应Ⅲ的反应剧烈程度比反应Ⅰ缓慢,说明溶液中Cl-浓度和生成的NaCl都会对反应的剧烈程度有一定的影响,D正确; 故选B。 5.A【解析】A.Na2O中阳离子是Na+、阴离子是O2-,Na2O2中阳离子是Na+、阴离子是O22-,个数比均为1:2,A正确; B.Na与Cl2、O2分别反应时产物中钠的化合价都是+1价,则等质量的Na反应,转移的电子数一样多,B错误; C.碳酸钠碱性较强,一般不用来治疗胃酸过多,可以用碳酸氢钠、氢氧化铝、碳酸钙等物质,C错误; D.钠投入水中会熔成小球,并四处游动,只能说明钠与水反应放热并生成气体,不能说明是氧气,D错误。 答案选A。 6.B【解析】Y与乙均为淡黄色固体,乙为单质,Y为二元化合物,所以乙为S,Y为Na2O2,甲单质的摩尔质量与S相同,均为32g/mol,甲应为O2,且Y(Na2O2)能与水或二氧化碳反应生成甲(O2),符合题意;氧气可以和M反应生成S单质,且X与氢离子反应生成M,所以M为H2S,则N为H2O;根据已知物质可知四种元素有H、O、Na、S,所以X为Na2S;A、B、C、D四种元素的原子半径依次增大,所以A为H元素、B为O元素、C为S元素、D为Na。 A.根据分析可知原子序数A<b<d<c,故a错误;<span=""></b<d<c,故a错误;<> B.氢离子核外不含电子,所以半径最小,Na+和O2-电子层结构相同,但氧离子核电荷数更小半径更大,S2-有3层电子,半径最大,所以离子半径:H+<na<span="">+<o<span="">2-<S2-,即A<D<b<c,故b正确;<span=""></b<c,故b正确;<></o<></na<> C.Y为Na2O2,除了离子键,还有氧原子之间的共价键,故C错误; D.虽然H2S的相对分子质量大于H2O,但水分子间存在氢键,沸点更高,故D错误; 故答案为B。 7.B【解析】A.用镊子从煤油中取出金属钠,用滤纸吸去表面煤油,切下绿豆大小的钠,小心放入装有水的烧杯中,观察Na与H2O反应的现象,故A错误; B.可燃物燃烧的条件之一是:温度达到着火点以上,Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧,说明过氧化钠和二氧化碳反应放出热量导致棉花的温度达到着火点以上而燃烧,故B正确; C.碳酸氢钠和碳酸钠都与氢氧化钙反应生成不溶性的碳酸钙,现象相同,所以不能用澄清石灰水鉴别碳酸氢钠和碳酸钠,故C错误; D.若NaCl溶液中混有硫酸氢钠,滴入盐酸酸化的氯化钡溶液也会产生沉淀,故D错误; 故答案为B。 8.B【解析】①碱金属是金属晶体,熔沸点与原子半径有关,原子半径越小熔沸点越高,铷的熔点比钾的低,故①错误; ②碳酸铷是强碱弱酸盐,水溶液呈碱性,故②正确; ③铷的金属性比钠强,所以氢氧化铷的碱性比氢氧化钠强,故③正确; ④铷的金属性比钠强,根据钠在空气中的燃烧产物为过氧化钠,可以推断铷在氧气中燃烧主要产物不是氧化铷,故④错误; ⑤铷的金属性比钠强,铷和盐溶液混合,铷先与水反应,铷不能从硫酸铜溶液中置换出金属铜,故⑤正确; 综上所述,对铷及其化合物性质的推断正确的是②③⑤,选B。 9.A【解析】锂的密度比水小,因此锂浮在水上,故①错误;②正确;锂和水反应生成LiOH和H2,溶液中能产生大量气泡,故③正确;生成的LiOH使紫色石蕊试液变蓝,故④错误;锂和水反应相对平缓,放出的热量并不能使锂融化,且生成的H2并不能推动锂四处游动,故⑤⑥错误;答案选A。 10.B【解析】A.焰色反应是元素的性质,和元素的存在形态无关,可能是含钠化合物,也可能是单质,故A错误; B.焰色反应的性质是元素的性质,物质灼烧时焰色反应为黄色,则一定含有钠元素,故B正确; C.只要含有钠元素焰色反应就呈黄色,不一定是钠单质,故C错误; D.只要含有钠元素焰色反应就呈黄色,所以能确定该试样中是否含有钠元素,故D错误; 答案选B。 11.(1)饱和碳酸氢钠溶液、浓硫酸;产生的气体使干燥管内液面降低,与碳酸钙脱离接触,反应停止;生成的硫酸钙微溶,附着在碳酸钙表面,阻止反应进一步进行(2)①D②碳(C)③4Na+3CO22Na2CO3+C 【解析】(1)根据发生的反应分析,产生的二氧化碳气体中,还含有氯化氢和水蒸气两种杂质,除去氯化氢用的是饱和碳酸氢钠溶液,除水蒸气用浓硫酸;反应结束后,关闭弹簧夹,产生的气体不能逸出,使干燥管里压强增大,干燥管内盐酸液面下降,与碳酸钙脱离接触,反应停止;若使用硫酸,生成的硫酸钙为微溶物,会附着在碳酸钙的表面,阻止反应进行。故答案为饱和碳酸氢钠溶液、浓硫酸;产生的气体使干燥管内液面降低,与碳酸钙脱离接触,反应停止;生成的硫酸钙微溶,附着在碳酸钙表面,阻止反应进一步进行。 (2)①向一支试管中滴加1滴酚酞溶液,溶液变红,说明是碱性物质,向第二支试管中滴加澄清石灰水,溶液变浑浊,说明能跟氢氧化钙反应生成沉淀,由此可推出该物质为碳酸钠,故选D; ②黑色固体与浓硫酸反应,生成的气体具有刺激性气味,说明发生了氧化还原反应生成了二氧化硫,故黑色固体是C;   声明: (责任编辑:admin) |