2021年高考化学一轮复习,离子反应考点详解
http://www.newdu.com 2025/11/30 10:11:29 三好网 佚名 参加讨论
为了帮助2021年高考生提高复习效率,高中化学老师给大家带来高考化学一轮复习的知识点详解,下面是有关离子反应考点详解的考点详解,收藏练习吧!  一、有关电解质的概念 1.电解质和非电解质:凡是在水溶液里或熔化状态下能导电的化合物叫做电解质。凡是在水溶液里或熔化状态下都不能导电的化合物叫做非电解质。 (1)单质既不是电解质也不是非电解质。 (2)当前状态下电解质不一定能导电,如食盐晶体、氯化氢气体等不导电。(氯化钠是阴阳离子构成的离子化合物,但由于静电的作用这些离子不能自由移动,因而干燥的氯化钠不能导电。当氯化钠溶于水时,水分子的作用减弱了钠离子和氯离子之间的作用,使氯化钠全部电离成自由移动的水合钠离子和水合氯离子。因而氯化钠溶液能够导电,像HCl这样的共价化合物在液态时虽不导电,但溶于水后,在水分子的作用下,也能全部电离成水合氢离子和水合氯离子) (3)电解质其自身能发生电离,如CO2、SO2、NH3溶于水能导电,是它们与水反应生成的化合物能电离出离子,而其自身并没有电离出离子,所以它们不是电解质,在水溶液中能导电化合物不一定是电解质。 (4)非电解质不导电,但不导电的物质不一定是非电解质,如有些难溶化合物在水中虽不导电,但在熔融状态下可能电离,因此也是电解质。(高中阶段很奇葩的一个知识点) (5)离子型氧化物(如Na2O、CaO等)虽然溶于水后并非自身电离,但熔融时却可电离,且完全电离,因此也是电解质。 2.强电解质和弱电解质:在水溶液里完全电离为离子的电解质叫做强电解质。包括强酸、强碱、绝大部分盐类和金属氧化物等等。在水溶液里只能部分电离为离子的电解质叫做弱电解质。包括弱酸、弱碱和水,及少数盐醋酸铅等。 (1)强电解质和弱电解质主要区别是在溶液里能不能完全电离,是否存在电离平衡,而不是溶液的导电能力的强弱。(溶液导电能力强弱与溶液中离子的物质的量浓度和离子所带电荷数有关) (2)难溶化合物(如BaSO4、AgCl)虽溶解度小,因溶解的部分能完全电离,但属强电解质。 (3)强电解质溶液导电性不一定强。如较浓醋酸的导电能力可比极稀HCl溶液强。CaCO3虽为强电解质,但溶于水所得溶液极稀,导电能力极差。 例1、下列叙述中正确的是() ①NaCl溶液在电流的作用下电离成钠离子和氯离子 ②溶于水后电离出氢离子的化合物都是酸 ③强电解质溶液的导电性比弱电解质溶液的导电性强 ④二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 ⑤BaSO4投入水中,导电性较弱,故它是弱电解质 ⑥弱电解质溶液中存在两种共价化合物分子 ⑦氯水能导电,所以Cl2是电解质 ⑧通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 ⑨乙醇和乙酸都能溶于水,都是电解质 例1、⑥ 【解析】物质的电离不需要电流,①错误;某些酸式盐,如NaHSO4溶于水后也会电离出H+,②错误;电解质溶液导电性的强弱与溶液中离子浓度的大小及所带电荷数有关,与电解质强弱没有必然联系,③错误;CO2溶于水,反应生成H2CO3,H2CO3电离出离子,而非CO2自身的电离,故H2CO3为电解质,CO2为非电解质,④错误;尽管BaSO4难溶于水,但溶解的部分全部电离,故其为强电解质,⑤错误;弱电解质溶液中,有未电离的弱电解质和水这两种共价化合物分子,⑥正确;氯气是单质,既不是电解质,也不是非电解质,⑦错误;溶液中的溶质若是不能电离的非电解质,则溶液中的溶质粒子不会移动,⑧错误;乙醇属于非电解质,⑨错误。    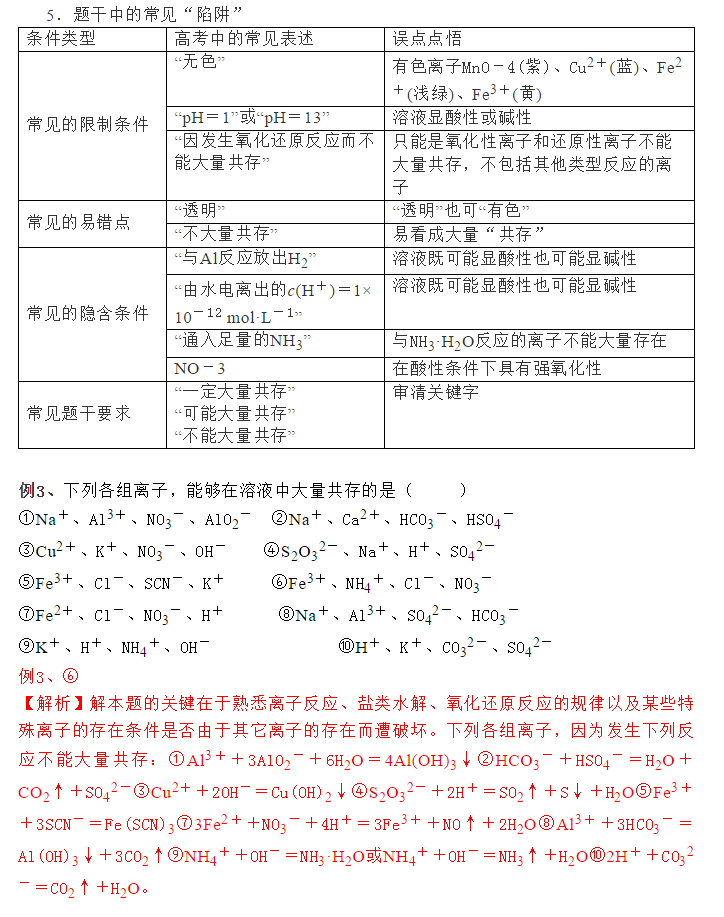   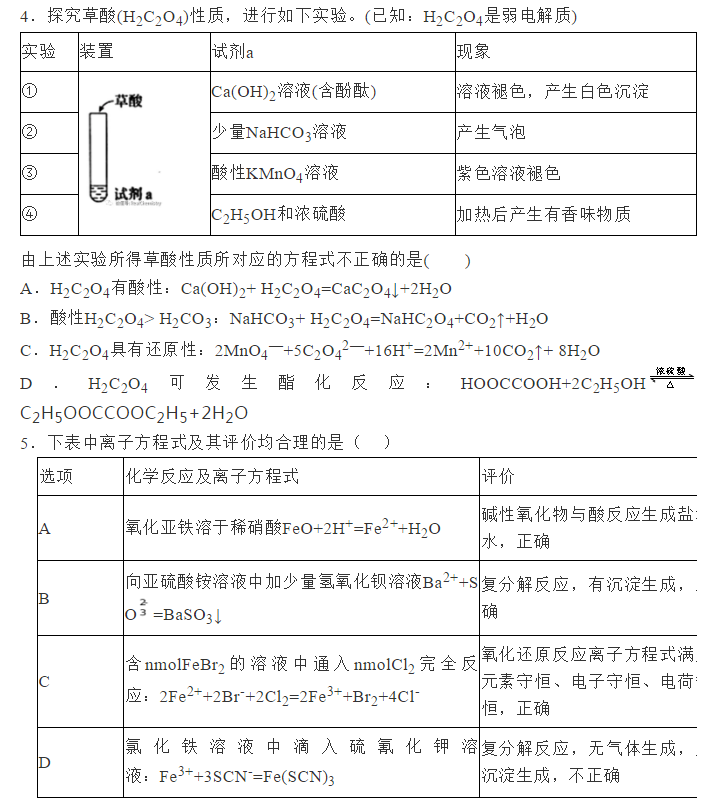        声明: (责任编辑:admin) |