2021年高考化学一轮复习,氧化还原反应考点详解
http://www.newdu.com 2025/12/01 06:12:50 三好网 佚名 参加讨论
为了帮助2021年高考生提高复习效率,高中化学老师给大家带来高考化学一轮复习的知识点详解,下面是有关氧化还原反应考点详解的考点详解,收藏练习吧!  一、氧化还原反应及其相关概念 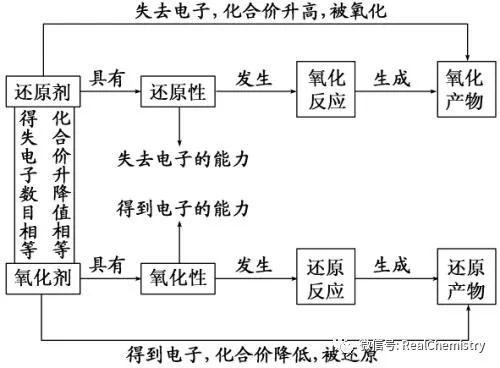 2.特征:反应前后元素化合价发生了变化。 同种元素,最高价态只有氧化性,最低价态只有还原性,中间价态既有氧化性又有还原性;在反应中,得到电子或所含元素化合价降低的物质均具有氧化性,失去电子或所含元素的化合价升高的物质具有还原性。 3.本质:反应过程中有电子转移(得失或偏移)。 4.规律:在一个化学反应中氧化反应和还原反应同时发生,氧化剂和还原剂同时存在,氧化剂得电子,还原剂失电子,得失电子同时发生。同一氧化还原反应中,氧化剂和还原剂得失电子总数相等,即化合价升高的总价数等于降低的总价数。 例1、下列有关氧化还原反应的叙述中正确的是。 ①在氧化还原反应中,某元素由化合态变为单质,此元素可能被还原,也可能被氧化 ②在氧化还原反应中,非金属单质一定是氧化剂,金属单质一定是还原剂 ③化合物分解的产物有单质,则该分解反应必属于氧化还原反应 ④化学反应K2MnO4+Cl2=2KCl+MnO2+O2属于氧化还原反应 ⑤金属阳离子只有氧化性,HI只有还原性 ⑥漂白粉在空气中变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生 ⑦某单质X能从盐的溶液中置换出单质Y,当X、Y都是非金属时,Y一定比X活泼 ⑧1molNa2O2与足量的水反应,转移的电子数为2NA ⑨5.6g铁粉与硝酸反应失去电子数一定为0.3NA 二、氧化还原反应中电子转移的表示方法 1.单线桥法:表示氧化剂中得电子元素与还原剂中失电子元素之间电子转移的方向和总数。  三、氧化还原反应的基本规律 1.守恒律:氧化还原反应中,氧化剂得电子总数与还原剂失电子总数相等,常用于有关氧化还原反应的计算及配平氧化还原反应方程式。运用守恒规律进行氧化还原反应的计算方法是:氧化剂物质的量×变价元素的原子个数×化合价的变化值=还原剂物质的量×变价元素的原子个数×化合价的变化值。 2.价态律:当元素具有可变化合价,一般化合价处于最高价态时只具有氧化性;处于最低价态时只具有还原性;处于中间价态时既具有氧化性又具有还原性。多元素化合物性质,由各元素性质综合决定。利用此规律可判断物质是否具有氧化性及还原性,但不能判断物质氧化性及还原性的强弱。 3.先后律:同一氧化剂与含多种还原剂的溶液反应时,首先被氧化的是还原性较强的物质;同一还原剂与含多种氧化剂的溶液反应时,首先被还原的是氧化性较强的物质。如:将Cl2通人物质的量浓度相同的NaBr和NaI的混合液中,C12首先与NaI反应;将过量铁粉加入到物质的量浓度相同的Fe3+和Cu2+的混合溶液中,Fe首先与Fe3+反应;FeBr2中通入Cl2,Cl2首先氧化Fe2+。 4.交错律:高价氧化(性)低价还(原性),中间价态两边转。同一元素的不同价态之间发生氧化还原反应,价态只能归中而不能交叉。本规律应用于氧化还原反应的分析和判断(如反应KClO3+6HCl===KCl+3C12↑+3H2O中氧化产物和还原产物均为C12,电子转移数目是5e-)。 同种元素由不同价态(高价态和低价态)转变为中间价态的氧化还原反应,当有中间价态时,才可能发生,否则不反应,如SO2与浓硫酸不反应,可用浓H2SO4干燥。 5.强弱律:氧化还原反应若能进行,一般为较强氧化性的氧化剂跟较强还原性的还原剂反应,生成较弱还原性的还原产物和较弱氧化性的氧化产物。 常用于比较物质间氧化性或还原性的强弱,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物。亦可用于在适宜条件下,用氧化性较强的物质制备氧化必较弱的物质或用还原性较强的物质制备还原性较弱的物质。 例3、L、M、R、P、Q分别代表五种含不同化合价的氮元素的物质。A、B分别代表两种含不同化合价的氯元素的物质(每种物质中氮或氯元素的化合价只有一种)。又知物质M中的氮元素化合价要比物质Q中氮元素的化合价低。在一定条件下,它们会发生如下的转化(关系式未配平):①P+A―→Q+B②L+O2―→M+H2O③L+M―→R+H2O④B+H2O―→A+O2 (1)若五种含氮元素的物质中,有一种是硝酸,则硝酸是________,理由是_____________。 (2)反应②必须在催化剂(铂、氧化铁等)作用下,加热到一定温度时方能发生,此反应在化工生产上有重要用途,据此推断在同温同压下,若物质R密度比空气的密度小,则R的化学式为________。 (3)某同学写出下面三个含氮的物质相互转换的关系式:Ⅰ.M+P―→N2O3+H2OⅡ.N2O4+H2O―→P+QⅢ.M+L―→Q+H2O其中一定不可能实现的是________,理由是______。 四、氧化性强弱、还原性强弱的比较 金属通常容易失去电子,只表现还原性,一般情况下将金属性认为就是其还原性;非金属通常容易得到电子,表现出氧化性,一般情况下将非金属性认为就是其氧化性。物质的氧化性或还原性的强弱只取决于得到或失去电子的难易,与得失电子的多少无关。 1.氧化性强弱的比较 (1)根据非金属活动顺序判断:氧化性:F2>O2>Cl2>Br2>I2>S; (2)根据反应方程式判断:氧化性:氧化剂>氧化产物; (3)根据反应条件判断:与相同的还原剂反应时,反应越容易进行,氧化剂的氧化性越强; (4)根据还原剂被氧化的程度判断:还原剂、条件都相同时,还原剂被氧化得价态越高,氧化剂的氧化性越强; (5)据电解池中放电顺序,先得电子者氧化性强,其规律为阳离子得电子顺序(即氧化性强弱顺序)。 2.还原性强弱的比较 (1)根据根据活动顺序表判断:  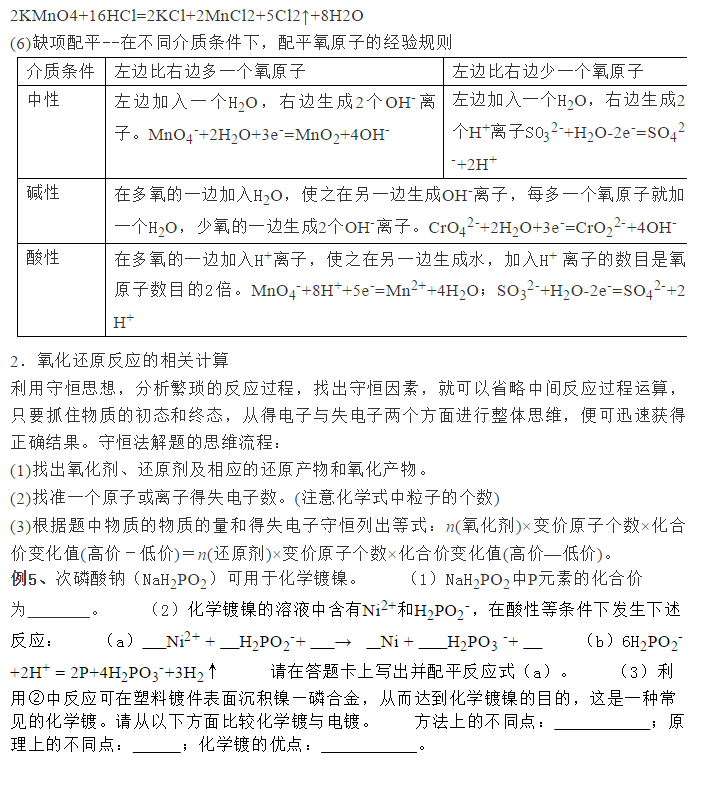          声明: (责任编辑:admin) |