高二化学选择性必修1第二章第二节化学平衡
http://www.newdu.com 2025/12/09 03:12:02 三好网 佚名 参加讨论
高中化学老师给大家带来高二化学选择性必修1,化学平衡的核心知识梳理,希望大家能够掌握,积极备战考试。 第1部分可逆反应 一、概念 在一定条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。 二、特点 1.同一条件下,正反应和逆反应同时发生、同时存在。 2.可逆反应在一定条件下不能进行到底,反应物不能实现完全转化。 第2部分化学平衡状态 一、化学平衡状态 1.概念:在一定条件下,当正反应速率与逆反应速率相等时,反应体系中所有参加反应的物质的质量或浓度可以保持恒定。这时的状态称为“化学平衡状态”,简称化学平衡。 2.特征 ①逆:化学平衡的研究对象是可逆反应。 ②等:化学平衡的本质特征是v正=v逆。 ③动:化学平衡是动态平衡,反应没停止,即v正=v逆≠0。 ④定:化学平衡表观特征是各组分的浓度(或百分含量等)保持恒定。 ⑤变:当外界条件改变时,化学平衡可能被破坏,并在新的条件下建立新的化学平衡,即发生化学平衡的移动。 ⑥同:在相同条件下,同一化学反应在两个不同的容器中分别达到化学平衡状态时,若同种物质的百分含量相同,则二者称为等效平衡(包括全等等效和相似等效)。 二、化学平衡状态的判断方法(即化学平衡的标志) 1.利用本质特征:“v(正)=v(逆)”(同物同值,异物同比)。 2.利用表观特征:“定”——平衡体系中某组分的某个量不再改变。 3.对于气体反应,可利用体系的性质[如气体压强(P)、气体体积(V)、混合气体密度(ρ)、混合气体平均相对分子质量(Mr)、温度(T)]等判断。 (1)在TV恒定条件下,对于△V≠0全气体反应,平衡的标志是P、Mr不再改变。 (2)在TP恒定条件下,对于△V≠0全气体反应,平衡的标志是V、ρ、Mr不再改变。 (3)在定温(T)条件下,对于△V=0全气体反应,上述性质均不能作为平衡标志。 (4)在定温(T)条件下,对于△V=0非全气体反应,平衡的标志是ρ、不再改变。 (5)在绝热容器中,平衡的标志是体系T不再改变。 三、化学反应条件的控制 1.化学反应条件的控制 (1)目的:促进有利的化学反应,抑制有害的化学反应。 (2)基本措施 ①改变化学反应速率:改变反应物的温度、溶液中溶质的浓度、气体压强(或浓度)、固体表面积以及催化剂的合理使用等; ②改变可逆反应进行的限度:改变可逆反应体系的温度、溶液中溶质的浓度、气体压强(或浓度)等。 2.提高煤的燃烧效率的措施 (1)尽可能使燃料充分燃烧,提高能量的转化率。关键是燃料与空气或氧气要尽可能充分接触,且空气要适当过量。 (2)尽可能充分利用燃料燃烧所释放出的热能,提高热能的利用率。 四、化学平衡的移动 1.平衡移动的概念 化学反应体系的平衡状态是可以通过改变反应条件(温度、浓度、气体反应的压强)而发生变化的,这种现象称作平衡状态的移动,简称平衡移动。 2.过程  特别强调: ①增加固体或纯液体的量,化学平衡不移动。 ②工业生产中适当增大廉价的反应物的浓度,以提高价格较高原料的转化率,降低生产成本。 ③在溶液中进行的反应,如果稀释溶液,反应物浓度减小,生成物浓度也减小,v正、v逆均减小,但减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数增大的方向移动。 2.压强对化学平衡的影响 在其他条件不变时,增大压强,化学平衡向气体体积减小的方向移动,减小压强,化学平衡向气体体积增大的方向移动。 特别强调: 压强对化学平衡的影响,实质上是浓度的影响。 ①无气态物质存在的化学平衡,改变压强不能使平衡发生移动。 ②对于反应前后气体体积不变的反应,增大压强,正逆反应速率同等程度增大,所以化学平衡不发生移动。 ③在容积不变的密闭容器中,若充入与反应体系无关的气体,化学平衡不移动。 ④在容积可变的恒压容器中,充入与反应体系无关的气体,此时容器体积变大,各气态物质的浓度减小(相当于减压),平衡向气体体积增大的方向移动。 3.温度对化学平衡的影响 在其他条件不变时,升高温度,化学平衡向吸热反应方向移动,降低温度会使化学平衡向放热反应方向移动。 特别强调: ①任何可逆反应的化学平衡状态,都能受温度的影响而发生移动。 ②若正反应为吸热反应,升高温度,使v正、v逆都增大,但v正增大的倍数更大,即v′正>v′逆,平衡向吸热反应方向移动。 4.催化剂与化学平衡 催化剂能同等程度地改变正、逆反应速率,能改变达到化学平衡的时间,但不能使化学平衡发生移动。 六、勒夏特列原理 如果改变影响平衡的条件之一(如温度,压强,以及参加化学反应的化学物质的浓度),平衡将向着减弱这种改变的方向移动。 对勒夏特列原理的理解: (1)对原理中“减弱这种改变”的正确理解应当是升高温度时,化学平衡向吸热反应的方向移动;增大压强时,化学平衡向体积缩小的方向移动。 (2)移动的结果只是减弱了外界条件的变化,而不能完全抵消外界条件的变化(类似物理学“楞次定律”)。达到平衡时,此物理量更靠近改变的方向。如增大反应物A的浓度,化学平衡右移,但达到新化学平衡时,A的浓度比原化学平衡时大。 特别强调: (1)不要把v(正)增大与化学平衡向正反应方向移动等同,只有v(正)>v(逆)时,才使化学平衡向正反应方向移动。 (2)不要把化学平衡向正反应方向移动与反应物转化率的提高等同。当增大一种反应物的浓度,使化学平衡向正反应方向移动时,会使另一种反应物的转化率提高,而本身的转化率降低。       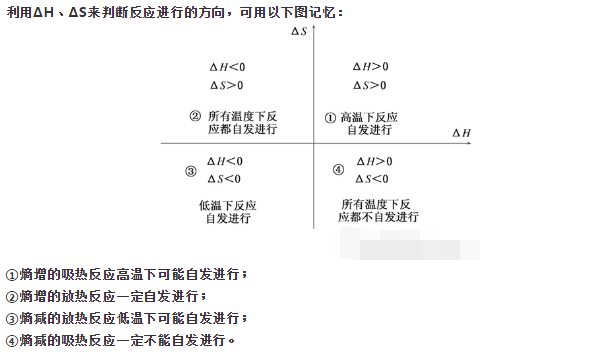 声明: (责任编辑:admin) |