高一化学必修一第二章氧化还原反应,知识点梳理
http://www.newdu.com 2025/12/01 05:12:39 三好网 佚名 参加讨论
对于高一学生来说,化学是一个全新的开始,如果你学的好,就是成绩的有效补充。如果学的不好,也有可能把你的成绩拉下去,成为一个更大的绊脚石!今天小编给新高一的同学们整理了高一化学必修一第二章氧化还原反应的分类知识梳理,接好吧!  氧化还原反应各概念之间的关系 1、反应类型: 氧化反应:物质所含元素化合价升高的反应。 还原反应:物质所含元素化合价降低的反应。 氧化还原反应:有元素化合价升高和降低的反应。 2、反应物: 氧化剂:在反应中得到电子的物质 还原剂:在反应中失去电子的物质 3、产物: 氧化产物:失电子被氧化后得到的产物 还原产物:得电子被还原后得到的产物 4、物质性质: 氧化性:氧化剂所表现出得电子的性质 还原性:还原剂所表现出失电子的性质 5、各个概念之间的关系如下图 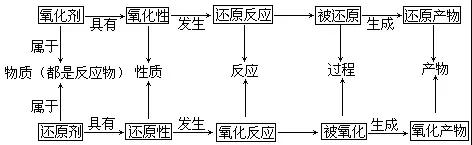 常见的氧化剂和还原剂 1、物质在反应中是作为氧化剂还是作为还原剂,主要取决于元素的化合价。 (1)元素处于最高价时,它的原子只能得到电子,因此该元素只能作氧化剂,如+7价的Mn和+6价的S (2)元素处于中间价态时,它的原子随反应条件不同,既能得电子,又能失电子,因此该元素既能作氧化剂,又能作还原剂,如0价的S和+4价的S (3)元素处于最低价时,它的原子则只能失去电子,因此该元素只能作还原剂,如-2价的S 2、重要的氧化剂 (1)活泼非金属单质,如F2、Cl2、Br2、O2等。 (2)元素处于高价时的氧化物、高价含氧酸及高价含氧化酸盐等,如MnO2,NO2;浓H2SO4,HNO3;KMnO4,KClO3,FeCl3等。 (3)过氧化物,如Na2O2,H2O2等。 3、重要的还原剂 (1)金属单质,如Na,K,Zn,Fe等。 (2)某些非金属单质,如H2,C,Si等。 (3)元素处于低化合价时的氧化物,如CO,SO2等。 (4)元素处于低化合价时的酸,如HCl(浓),HBr,HI,H2S等。 (5)元素处于低化合价时的盐,如Na2SO3,FeSO4等。 电子转移的表示方法 电子转移的表示方法有双线桥法和单线桥法: 1、双线桥法 要点: (1)箭头由反应物中化合价变化元素指向生成物中化合价已经变化了的同一元素。(升高、降低各一根箭头,越过方程式中间的等号) (2)电子转移数目:化合价升高、失电子;化合价降低、得电子。化合价改变元素的原子个数m×每个原子得到(或失去)电子的个数ne-,即m×ne-。如:  氧化还原反应的反应规律 1、价态规律 同种元素,处于最高价态时只具有氧化性。处于最低价态时只具有还原性。处于中间价态时既有氧化性又有还原性。 2、歧化和归中规律 价态归中规律:同种元素不同价态之间发生氧化还原反应时,价态的变化“只靠拢,可相交,不相叉”。 3、反应先后规律 在浓度相差不大的溶液中: (1)同时含有集中还原剂时,加入氧化剂后,还原性强的优先被氧化。 (2)同时含有集中氧化剂时,加入还原剂后,氧化性强的优先被还原。  4、守恒规律 在任何氧化还原反应中:化合价升高总数=化合价降低总数,还原剂失电子总数=氧化剂得电子总数。并且反应前后电荷数相等。 氧化性与还原性的强弱判断规律 1、根据氧化还原反应方程式的判断 氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物 可总结为:比什么性,找什么剂,产物之性弱于剂。 2、根据金属活动性顺序判断 KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu 从左向右还原性逐渐减弱,对应离子的氧化性逐渐增强 3、根据反应条件和反应的剧烈程度 反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强。 4、根据氧化性还原反应的程度 相同条件下: (1)不同氧化剂作用于同一种还原剂,氧化产物价态高的氧化性强。 (2)不同还原剂作用于同一种氧化剂,还原产物价态低的还原性强。 氧化还原反应方程式的配平 1、三个原则:得失电子守恒原则,原子守恒原则,电荷守恒原则 2、一般方法:化合价升降法联合最小公倍数法 3、配平技巧: (1)正向配平法:先从氧化剂和还原剂开始配平。 适用范围:分子间的氧化还原反应,所有元素参与的氧化还原反应,生成物中物质即是氧化物又是还原产物。 (2)逆向配平法:先从氧化还原产物开始配平。 适用范围:自身氧化还原反应,反应物中某一部分被氧化或被还原 (3)整体配平发:当某一元素的原子或原子团(多见于有机反应配平)在某化合物中有数个时,可将它作为一个整体对待,根据化合物中元素化合价代数和为零的原则予以整体标价。 (4)缺项配平法 如果所给的化学方程式中有反应物或生成物没有写出来,在配平时,如果所空缺的物质不发生电子的得失,仅仅是提供一种发生反应的酸、碱、中性的环境,可先把有化合价升降的元素配平,最后根据电荷守恒和原子守恒确定缺项物质,配平。 (5)其他配平法 ①奇偶配平法 这种方法适用于化学方程式两边某一元素多次出现,并且两边的该元素原子总数有一奇一偶,例如:C2H2+O2→CO2+H2O。 ②观察法配平 有时方程式中会出现一种化学式比较复杂的物质,我们可通过这个复杂的分子去推其他化学式的系数,例如:Fe+H2O——Fe3O4+H2。 ③归一法 做法:选择化学方程式中组成最复杂的化学式,设它的系数为1,再依次推断。 氧化还原反应的相关计算 1、计算依据:氧化剂得到的电子总数等于还原剂失去的电子总数。 2、计算公式:氧化剂的物质的量×变价元素原子的个数×化合价的变化值等=还原剂的物质的量×变价元素原子的个数×化合价的变化值。 (责任编辑:admin) |