高一化学必修一第二章化学物质及其变化,知识点梳理
http://www.newdu.com 2025/11/30 11:11:12 三好网 佚名 参加讨论
对于高一学生来说,化学是一个全新的开始,如果你学的好,就是成绩的有效补充。如果学的不好,也有可能把你的成绩拉下去,成为一个更大的绊脚石!今天小编给新高一的同学们整理了高一化学必修一第二章化学物质及其变化的知识梳理,接好吧!  考点一:熟记常见无机化合物的分类  【注意】判断氧化物所属类别时,一定要注意以下几点: (1)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为两性氧化物、Na2O2为过氧化物)。 (2)酸性氧化物不一定是非金属氧化物(如Mn2O7); 非金属氧化物也不一定是酸性氧化物(如CO、NO)。 (3)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、Fe2O3)。 (4)酸性氧化物都是对应酸的酸酐,但酸酐不一定都是酸性氧化物,如乙酸酐[(CH3CO)2O]。 考点二:胶体知识总结 1.胶体区别于其他分散系的本质特征是分散质颗粒直径大小(1~100nm)。 2.常见胶体 Fe(OH)3胶体、Al(OH)3胶体、血液、豆浆、淀粉溶液、蛋白质溶液、有色玻璃、墨水等。 3.Fe(OH)3胶体的制备方法 将饱和FeCl3溶液滴入沸水中,继续加热至体系呈红褐色,停止加热,得Fe(OH)3胶体。 4.胶体的提纯:渗析法 胶体的提纯:渗析(用半透膜);胶体与浊液的分离:过滤(滤纸) 5.区分胶体和其他分散系的最简便方法是利用丁达尔效应。 6.胶体的应用: 胶体的在生活、生产和科研等方面有着重要用途,如常见的有: ①盐卤点豆腐 ②肥皂的制取分离 ③明矾、Fe2(SO4)3溶液净水 ④FeCl3溶液用于伤口止血 ⑤江河入海口形成的沙洲 ⑥冶金厂大量烟尘用高压电除去 ⑦土壤胶体中离子的吸附和交换过程,保肥作用; ⑧纳米技术与胶体  考点三:电解质和非电解质 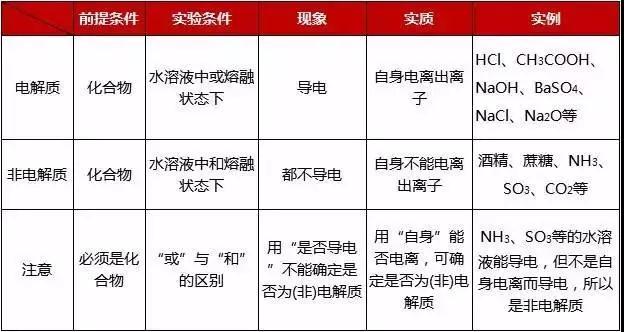 【注意要点】 (1)电解质不一定导电,不导电的物质不一定是非电解质。 (2)非电解质不导电,导电的物质不一定是电解质。 (3)单质、混合物既不是电解质,也不是非电解质。 (4)电解质必须是化合物本身电离出离子,否则不属于电解质,如CO2、NH3、Cl2等物质的水溶液虽能导电,但它们并不是电解质,它们的水溶液能导电是因为与水反应后生成了电解质。 【归纳总结】 强化记忆盐、碱溶解性 钾、钠、铵盐、硝酸盐都易溶; 硫酸盐不溶铅和钡;盐酸盐不溶银亚汞; 微溶物有四种;强碱都易溶,Ca(OH)2是微溶。 【说明】 (1)四种微溶物是指Ag2SO4、CaSO4、MgCO3、Ca(OH)2。 (2)AgCl、AgBr、AgI、BaSO4及微溶的CaSO4、Ag2SO4都难溶于稀强酸。 (责任编辑:admin) |