必修1·综合质量检测 (四) 非金属及其化合物
http://www.newdu.com 2025/11/07 02:11:33 人民教育出版社 佚名 参加讨论
必修1·综合质量检测 (四) 非金属及其化合物 黑龙江省庆安一中 孙秀民 第Ⅰ卷(选择题,共54分) 一、选择题(每小题3分,共54分) 1.为迎接北京奥运,北京曾采用机动车按照单双号行驶的方案,该方案既保障了交通秩序,又大大减少了空气污染。汽车尾气中所含污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还主要含有( ). A.氮气 B.硫化氢 C.二氧化硫 D.氮的氧化物 2.某地发生了食用熟牛肉中毒事件,导致四个死亡、一百多人中毒。经过对该牛肉的检测,发现其中某盐的含量比国家标准允许的含量高800多倍,则该盐可能是( ). A.NaNO2 B.NaNO3 C.NaCl D.BaSO4 3.下列现象或事实可用同一原理解释的是( ). A.浓硫酸和浓盐酸长期暴露在空气中浓度降低 B.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色,其原理相同 C.漂白粉和水玻璃长期暴露在空气中变质 D.能使品红溶液褪色的气体不一定是SO2 4.绿色化学实验是在绿色化学思想指导下的实验新方法,以减少污染,防止浪费等。下列符合绿色化学实验的是( ). A.用铜与浓硫酸反应制取CuSO4,并用少量品红溶液吸收尾气 B.将CO还原Fe2O3后的尾气直接排入空气中 C.用CCl4完成萃取操作练习时,将溴水改成碘水 D.将Zn和稀硫酸制H2后的废液倒入水槽后再清洗玻璃仪器 5.烧瓶中放入铜片和稀硝酸,用酒精灯加热来制取较纯净的一氧化氮,反应开始后发现烧瓶中充满棕红色气体,这时的操作应是( ). A.立即接收集容器,用向上排空气法收集 B.待烧瓶中红棕色气体消失后,用向上排空气法收集 C.待烧瓶中红棕色气体消失后,用排水法收集 D.立即用排水法收集 6.下列关于氨气的说法正确的是( ). 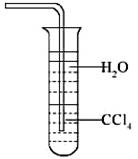 A.氨既能用浓硫酸干燥也能用无水CaCl2干燥 B.NH3是电解质,所以氨水能导电 C.沸点:NH3<PH3<AsH3 D.用水吸收NH3用如图装置可防止倒吸 7.为了证明[(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)]的成分中含有NH、Fe2+、SO和H2O,下列实验叙述中不正确的是( ). A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO D.取少量硫酸亚铁铵放入试管,加入少量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中含有NH 8.有a、b、c、d、e五种气体,进行下列实验:
a、b、c、d、e依次可能是( ). A.O2、NO、HCl、NH3、CO2 B.O2、NO、NH3、HCl、SO3 C.NO、O2、NH3、HCl、SO2 D.HCl、CO2、NH3、H2S、CH4 9.下列对实验现象的预测不正确的是( ). A.向Na2SiO3溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 B.向氢氧化铁胶体中滴加盐酸至过量,开始有沉淀出现,后来沉淀又溶解 C.向Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 D.向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入过量NaOH溶液,溶液又变浑浊 10.根据陈述的知识,类推得出的结论正确的是( ). A.磷在足量氧气中燃烧生成一种相应氧化物,则碳在足量氧气中燃烧生成一种氧化物 B.稀硝酸能将木炭氧化成二氧化碳,同理稀硫酸也能将木炭氧化成二氧化碳 C.CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似 D.NaHCO3、(NH4)2CO3固体受热后均能生成气体,则Na2CO3固体受热后也能生成气体 11.奥运会会标是五环旗,假定奥运五环旗中的一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( ). 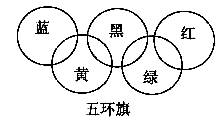
12.有一瓶可能部分被氧化的Na2SO3溶液,某同学进行如下实验:取少量此溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。下述有关此实验的结论正确的是( ). A.Na2SO3已部分被空气中的氧气氧化 B.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 C.加硝酸后的白色沉淀不一定是BaSO4 D.此实验不能确定Na2SO3是否部分被氧化 13.实验室有一瓶久置的白色K2SO3粉末,元素分析表明粉末中K和S元素的质量比为39∶16,下列结论正确的是( ). A.根据元素分析结果推测该粉末为纯净物 B.将粉末溶于水,加入氯化钡,有白色沉淀生成,证明原粉末是K2SO4 C.将粉末加入盐酸中,产生气泡,证明原粉末是K2SO3 D.将粉末溶于水,加入氯化钡和过量的盐酸,有白色沉淀和气泡生成,证明原粉末是K2SO4和K2SO3的混合物 14.工业上以硫铁矿为原料制硫酸所产生的尾气中含有SO2,为便于监控,实施环境保护,下列适合测定硫酸尾气中SO2含量的试剂是( ). A.品红溶液 B.氨水、酚酞试液 C.碘水、淀粉溶液 D.以上都可以 15.(2009·吉林七校)向含有下列离子的溶液中,通入适量的氯气会引起离子浓度减少的是( ). ①HCO ②SO ③OH- ④Fe2+ A.①② B.③④ C.①②③ D.①②③④ 16.某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的教材上的实验。实验操作:先给钠预热,当钠熔成圆球时,撤火、通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述错误的是( ). 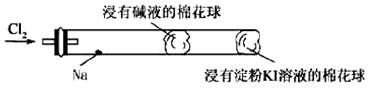 A.钠着火燃烧产生苍白色火焰 B.反应生成的大量白烟是氯化钠晶体 C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 D.管右端棉球外颜色变化可判断氯气是否被碱液完全吸收 17.在氯水中存在多种分子和离子,可通过实验的方法加以确定,下列说法中可能错误的是( ). A.加入含有NaOH的酚酞试液,红色褪去,说明有H+存在 B.加入有色布条后,有色布条褪色,说明有HClO分子存在 C.氯水呈浅黄色,且有刺激性气味,说明有Cl2分子存在 D.加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在 18.已知BrCl能发生下列反应:nBrCl+2M===MCln+MBrn(M为+n价的金属元素),BrCl+H2O===HCl+HBrO,以下推论不正确的是( ). A.BrCl具有和卤素单质相似的化学性质 B.BrCl和M反应时,BrCl只做氧化剂 C.BrCl和NaOH溶液反应生成NaCl、NaBrO两种盐 D.将BrCl跟FeSO4溶液反应,溶液会变成无色 第Ⅱ卷(非选择题,共46分) 二、非选择题(共46分) 19.氰(CN)2的化学性质与卤素很相似(X2),称为拟卤素,氰能和氢气反应生成HCN,其水溶液是一种酸。氰的氧化性比溴弱、比碘强。 (1)HCN分子中含有4个共价键,写出HCN的结构式:____________。 (2)KCN溶液显碱性,原因是____________(用离子方程式表示)。 (3)下列有关方程式不正确的是____________。 A.(CN)2+2NaOH===NaCN+NaCNO+H2O B.MnO2+4HCN===Mn(CN)2+(CN)2+2H2O C.I2+2KCN===2KI+(CN)2 D.向NaBr(aq)和KCN(aq)中加入少量Cl2:Cl2+2NaBr===2NaCl+Br2 (4)处理CN-的工业废水常用ClO-氧化处理生成CNO-,反应的离子方程式如下: aCN-+bClO-+2cOH-===dCNO-+eN2+fCO+bCl-+cH2O 上述化学方程式可能的配平化学计量数有多组,回答下列问题。 ①方程式中e∶f的值为____________; A.1 B.1/2 C.2 D.不能确定 ②若d=e=1,则b=____________。 20.饮用水质量是关系人类健康的重要问题。 (1)氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为____________,所生成的次氯酸的电子式为____________。 (2)写出工业上制取漂白粉的化学反应方程式:____________。 (3)ClO2被称为“第四代”饮用水杀虫剂,因其高效率,无污染而被广泛使用。制备ClO2是发达国家普遍重视的课题,我国北京永利科技有限公司已用电解法批量生产ClO2。其反应原理为:4ClO+4H+===4ClO2+O2↑+2H2O,试写出两电极反应式,阳极:____________;阴极:____________。 (4)相同物质的量的氯气与二氧化氯消毒时转移电子数目之比是____________。 (5)采用氧的一种同素异形体给自来水消毒,既提高了消毒效率、安全无副作用,又因为该物质在自然界中存在,对地球生命体起保护伞作用,该物质和氯气溶于水以及SO2的漂白原理分别是____________;____________。若将氯气与SO2二者混合,若想使石蕊试液褪色则范围为____________。 21.硫酸具有以下A~F的性质:A.酸性 B.高沸点难挥发 C.吸水性 D.脱水性 E.强氧化性 F.溶于水放出大量热 (1)浓硫酸与铜共热发生反应的化学方程式为____________。实验中往往有大量白色固体析出,可见浓硫酸在该实验中表现了哪些性质:____________。(浓硫酸性质用A、B、C、D、E、F填空,下同) (2)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液。铜屑在此状态下被溶解的化学方程式为__________________________________。硫酸在该反应中表现了哪些性质:__________________。 (3)在过氧化氢跟稀硫酸的混合溶液中加入铜片,常温下就生成蓝色溶液。写出有关反应的化学方程式:____________。与(2)中反应比较反应条件不同的原因是____________。 (4)蔗糖晶体中滴2~3滴水,再滴入适量的浓硫酸。发现加水处立即变黑,黑色区不断扩大,最后变成一块疏松的焦炭,并伴有刺激性气味气体产生。写出产生有刺激气味气体的化学方程式:____________________________。该实验中浓硫酸表现的性质有____________________。 (5)工业制备CuSO4溶液采用实验(2)的原理而没有采用实验(1)和(3)的原理,是因为(1)和(3)有某些缺点,请你列举(1)和(3)分别有哪此缺点:实验(1)____________________________;实验(3)____________________________。 22.某课外兴趣小组对双氧水(H2O2水溶液)做了如下实验探究。 (1)将质量相同但聚集状态不同的MnO2分别加入 5 mL 5%的双氧水中,并用带火星的木条试之。测定结果如下:  ①写出H2O2反应的化学方程式:__________________;②实验结果说明催化剂作用的大小与__________有关。 (2)取三份含有等量H2O2、但质量分数不同的双氧水,分别向其中加入 1 g MnO2粉末。测定结果如下,请简要说明: 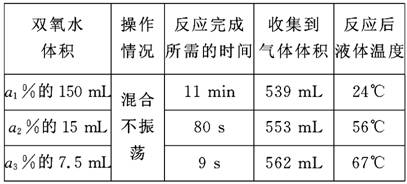 ①反应完成所需的时间不同的原因:________________;②反应后液体温度不同的原因:____________________; ③收集到气体体积不同的原因:______________。 (3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去。 ①已知双氧水显弱酸性,试写出H2O2的电离方程式:______________________; ②小组讨论红色褪去的原因时,甲同学认为是双氧水显酸性所致;乙同学认为是双氧水有较强氧化性所致。请你设计一个简单实验来说明是甲对还是乙对(简要文字说明): ____________________________________ 。 参考答案 一、选择题(每小题3分,共54分) 1.解析:汽车的尾气中,除了含有碳氢化合物、可吸入颗粒物、一氧化碳外,还含有氮的氧化物,汽车尾气最主要的危害是形成光化学烟雾。 答案:D 2.解析:亚硝酸盐是工业用盐,它在外观上类似食盐,误食会引起中毒,国家标准中,肉制品的亚硝酸盐含量是被限制使用的;由题意知,该盐为NaNO2,A项正确;NaNO3、NaCl、BaSO4食用后,不会引起中毒现象,B、C、D项不正确。 答案:A 3.解析:浓硫酸浓度降低的原因是由于吸水,而浓盐酸浓度降低的原因是由于氯化氢气体的挥发,所以两者不能用同一原理解释,A项错误;SO2漂白是利用其与有色物质化合,生成不稳定的无色物质,漂白粉、过氧化钠漂白是利用其强氧化性,破坏有色物质的结构,而活性炭使红墨水褪色,是由于活性炭具有吸附性,将有色物质吸附在活性炭的表面,故漂白原理不同,B项错误;漂白粉在空气中变质是由于吸收CO2和水生成HClO,然后见光分解,而水玻璃的变质是由于与空气中的CO2反应生成了硅酸的缘故,两者也不能用同一原理解释,C项错误;能使品红溶 液褪色的物质除SO2外,氯水、过氧化钠等也可使品红溶液褪色,D项正确。 答案:D 4.解析:品红溶液可以用来检验SO2气体,但不能用来吸收尾气,A项错误;CO还原Fe2O3后的尾气中含有少量CO气体,直接排放到空气中造成污染,B项错误;溴易挥发,而碘不易挥发,C项正确;锌与稀硫酸制氢气后的废液倒入水槽会污染环境,D项错误。 答案:C 5.解析:在制取NO过程中,常常会混有NO2气体,要得到纯净的NO,需除去混有的NO2的气体。直接用向上排空气法收集,不能得到纯净的NO气体,A项错误;NO中的NO2是由于NO和装置内的空气发生反应得到的,所以不能自行消失,B、C项错误;由于NO2溶于水且与水反应生成NO和硝酸,故可以直接用排水法收集到纯净的NO,D项正确。 答案:D 6.解析:氨气是碱性气体,不能用浓硫酸干燥,A项错误;氨本身不能发生电离,NH3是非电解质,其水溶液导电是由于生成的NH3·H2O发生电离产生自由移动的离子,B项错误;由于NH3分子之间可形成氢键,故其沸点比PH3高,C项错误;四氯化碳为非极性分子,NH3是极性分子,不溶于四氯化碳,故可防止倒吸,D项正确。 答案:D 7.解析:将晶体加热,试管口有液体,可证明晶体中有结晶水,A项正确;Fe2+遇KSCN溶液不变色,加入氯水后可被氧化为Fe3+,溶液变血红色,可证明有Fe2+的存在,B项正确;溶液中加入盐酸酸化,再滴入BaCl2溶液,有白色沉淀生成,则可证明含有SO,C项正确;在溶液中加入稀NaOH溶液,不能产生NH3,故不能用湿润的红色石蕊试纸检验,D项错误。 答案:D 8.解析:由a和b混合,气体变成红棕色,可知a和b为NO与O2的混合气;b通入氢硫酸中产生淡黄色沉淀,则b为氧气,a为NO;c和d混合产生白烟,则c和d为NH3、HCl的混合气;c通入少量溴水中溴水变成无色透明的液体,则c为NH3,d为HCl;e通入少量溴水中,溴水变成无色透明的液体,e通入氢硫酸中产生淡黄色浑浊,则e为SO2。 答案:C 9.解析:Na2SiO3溶液中通入CO2,Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3,通入CO2过量,生成NaHCO3,但H2SiO3沉淀不溶解,A项错误;向氢氧化铁胶体中加入盐酸,开始由于胶体发生聚沉,出现沉淀,随着反应Fe(OH)3+3HCl===FeCl3+3H2O进行,沉淀溶解,B项正确;Ca(ClO)2溶液中通入CO2, Ca(ClO)2+CO2+H2O===2HClO+CaCO3↓,次氯酸具有强氧化性,使品红溶液褪色,C项正确;将CO2通入Ca(OH)2溶液中会发生反应CO2+Ca(OH)2===CaCO3↓+H2O,生成白色沉淀,继续通入CO2至过量后发生反应 CO2+H2O+CaCO3===Ca(HCO3)2,沉淀消失溶液又变澄清,若向溶液中加入NaOH溶液,又会发生反应Ca(HCO3)2+2NaOH===CaCO3↓+Na2CO3+2H2O,生成白色沉淀,溶液又变浑浊,D项正确。 答案:A 10.解析:磷与足量的氧气反应,只生成P2O5,在氧气充足的条件下,C在氧气中燃烧的产物也只有CO2,A项正确;稀硝酸有强氧化性,可将木炭氧化成CO2,稀硫酸无强氧化性,与木炭不反应,B项错误;CO2为分子晶体,而SiO2为原子晶体,所以它们的物理性质不同,C项错误;Na2CO3的热稳定性很好,加热很难发生分解,D项错误。 答案:A 11.解析:可采用排除法。A项中无置换反应,A项错误;O2与Fe发生化合反应,铁与稀硫酸发生置换反应,稀H2SO4、CO2与NaOH溶液发生复分解反应,B项正确;C项中无置换反应,C项错误;D项中无化合反应,D项错误。 答案:B 12.解析:Na2SO3具有还原性,放置在空气中易被氧化为Na2SO4,取少量溶液加入Ba(NO3)2溶液,产生白色沉淀,可能是BaSO3,亦可能是被氧化后生成了BaSO4,亦可能二者兼有,加入足量的稀硝酸,仍有白色沉淀,此时沉淀为BaSO4;因BaSO3、BaSO4都是白色沉淀,故此实验不能确定Na2SO3溶液是否部分被氧化,故A、B、C项错误,D项正确。 答案:D 13.解析:亚硫酸钾具有还原性,易被空气氧化为K2SO4,K2SO3与K2SO4中K和S元素的质量比都为39∶16,故从元素分析结果中不能确定该粉末为纯净物,A项错误;K2SO3与K2SO4都会与氯化钡反应生成白色沉淀,故加入氯化钡也不能证明原粉末中含有K2SO4,B项错误;粉末与盐酸反应产生气泡,只能证明粉末中含有K2SO3,但不能确认其是否变质,C项错误;加入过量盐酸,有气体生成,证明粉末中含有K2SO3,且同时加入氯化钡有白色沉淀生成,证明粉末中含有K2SO4,D项正确。 答案:D 14.解析:品红不能精确测定硫酸中SO2的含量,A项错误;氨水会与硫酸反应,使测量结果误差较大,B项错误;碘水与SO2反应生成I-,可根据淀粉溶液变化情况,测量SO2的含量,C项正确。 答案:C 15.解析:氯气通入溶液中形成氯水,HCO与其中的H+反应而使其减少;氯气具有强氧化性,可将SO氧化为SO而使其减少;氯水中含有的H+会中和OH-而使其减少;Fe2+会被氧化成Fe3+而使其减少。 答案:D 16.解析:钠燃烧的火焰呈黄色,A项错误;氯气与钠反应生成大量的白烟,产物为氯化钠,B项正确;氯气是一种有毒的气体,实验中要考虑其污染,用碱液可吸收多余的氯气,C项正确;氯气与淀粉KI溶液反应生成的I2会使溶液变蓝,可用此现象检验氯气是否吸收完全,D项正确。 答案:A 17.解析:氯气溶于水,且与水发生反应,氯水的成分呈现多样性,加入含有NaOH的酚酞试液,红色褪去,可能是氯水中的H+恰好与OH-中和,也可能是HClO漂白,A项错误;HClO有强氧化性,可使有色布条褪色,B项正确;氯水中因含有Cl2分子而呈浅黄色,C项正确;氯水中含有Cl-,与硝酸酸化的AgNO3溶液反应产生白色沉淀,D项正确。 答案:A 18.解析:根据题中信息,BrCl能与金属、水反应,其性质与卤素的单质相似,A项正确;BrCl和M反应时,Br元素化合价降低,Cl元素化合价不变,BrCl只做氧化剂,B项正确;BrCl+2NaOH===NaCl+NaBrO+H2O,C项正确;BrCl的氧化性介于氯与溴之间,跟FeSO4溶液反应,会把Fe2+氧化成Fe3+,D项错误。 答案:D 二、非选择题(共46分) 19.解析:(1)HCN分子中含有4个共价键,则HCN的结构式为H-C≡N。(2)KCN是强碱弱酸盐,水解呈碱性,其水解方程式为CN-+H2O===HCN+OH-。(3)氰的氧化性比溴弱、比碘强,所以碘单质不能氧化KCN而制备(CN)2,C项错误;一种氧化剂与不同还原剂反应时,先氧化还原性强的物质,所以,加入少量的氯气,应先氧化KCN,Cl2+2KCN===2KCl+(CN)2,D项错误。(4)根据氢原子守恒,c=1;根据N原子守恒,2e+d=a,根据C原子守恒,d+f=a,则可知f=2e,e∶f=1∶2;若d=e=1,根据O原子守恒,2c+b=d+3f+c,代入数值,则b=6。 答案:(1)H-C≡N (2)CN-+H2O===HCN+OH- (3)CD (4)B 6 20.解析:(1)氯气与水反应的离子方程式为Cl2+H2O===H++Cl-+HClO。(2)漂白粉的主要成分为CaCl2和Ca(ClO)2,制取漂白粉是利用氯气与碱反应的性质,反应的方程式为2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。(3)阳极发生氧化反应,电极反应式为2H2O-4e-===O2↑+4H+;阴极发生还原反应,电极反应式为4ClO+4e-+8H+===4ClO2↑+2H2O。(4)1 mol Cl2消毒时转移电子为2 mol,1 mol 二氧化氯消毒时转移电子为5 mol,二者转移电子数之比为2∶5。(5)根据题中信息,氧气的同素异形体为臭氧,臭氧与氯气的漂白原理都是利用了其强氧化性;将有机色素氧化,漂白后不可恢复,SO2漂白是利用其与有色物质直接化合,生成不稳定的无色物质,褪色后在一定条件下又能恢复为原来的颜色;氯气与SO2混合,发生的反应为Cl2+SO2+2H2O===H2SO4+2HCl,若二者等物质的量混合,生成物无漂白性,若要使石蕊试液褪色,则>1。 答案:(1)Cl2+H2O===H++Cl-+HClO (2)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O (3)2H2O-4e-===O2↑+4H+ 4ClO+4e-+8H+===4ClO2↑+2H2O (4)2∶5 (5)强氧化性 强氧化性 化合反应 >1 21.解析:(1)浓硫酸有强氧化性,与铜共热的化学方程式为2H2SO4(浓)+CuCuSO4+SO2↑+2H2O,反应中硫元素化合价由+6价降低到+4价,硫酸表现了氧化性,同时,硫酸有一部分化合价未改变,表现出了酸性,浓硫酸吸收了反应生成的水,使反应中有大量白色固体出现,表现了吸水性。(2)废铜屑倒入热的稀H2SO4中并通入空气制备CuSO4溶液的反应方程式为2Cu+O2+2H2SO42CuSO4+2H2O,硫酸表现出了强酸性。(3)过氧化氢有强氧化性,在常温下跟稀硫酸的混合溶液中加入铜片的反应方程式为Cu+H2O2+H2SO4===CuSO4+2H2O,由此可证明过氧化氢的氧化性大于氧气。(4)蔗糖中滴加几滴浓硫酸,会产生有刺激性气味的气体,且产生疏松多孔的黑色物质,说明浓硫酸有脱水性、吸水性、强氧化性,同时,浓硫酸溶于水会放出大量的热,反应的方程式为2H2SO4(浓)+CCO2↑+2SO2↑+2H2O。(5)工业制备硫酸铜主要从成本和污染两方面考虑,实验(1)生成的SO2污染环境,且硫酸的利用率低;实验(3)增加了成本,经济效益低。 答案:(1)2H2SO4(浓)+CuCuSO4+SO2↑+2H2O ACE (2)2Cu+O2+2H2SO42CuSO4+2H2O A (3)Cu+H2O2+H2SO4===CuSO4+2H2O 过氧化氢的氧化性比氧气强 (4)2H2SO4(浓)+CCO2↑+2SO2↑+2H2O CDEF (5)制备CuSO4时产生的SO2污染环境,且硫酸的利用率低 原料成本高,经济效益低 22.解析:(1)过氧化氢在二氧化锰做催化剂条件下反应的方程式为2H2O22H2O+O2↑,由于催化剂的表面积不同,所以反应的速率不同,产生气体的量不同。(2)相同质量的过氧化氢与相同状态的MnO2粉末作用,由于反应物浓度不同、液体温度不同,所以反应的速率不同,浓度越大,温度越高反应所需时间越短,由于反应中液体的量不同,故反应后液体温度不同;由于液体的量不同、液体的温度不同,影响气体在溶液中的溶解量,故反应后产生的气体的量不同。(3)H2O2的电离方程式为H2O2HO+H+,含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去,在褪色后的溶液中再加入NaOH溶液,若红色恢复说明甲对,若红色不恢复,则说明乙对。 答案: (1)①2H2O22H2O+O2↑ ②催化剂的表面积(聚集状态) (2)①溶质质量分数不同,液体温度不同 ②反应放热相同,但液体的量不同 ③液体的量不同,液体温度不同(影响气体在溶液中的溶解量) (3)①H2O2HO+H+ ②在褪色溶液中再逐滴加入NaOH溶液,若红色恢复说明甲对,若红色不恢复则说明乙对。 (责任编辑:admin) |
- 上一篇:《从实验学化学》单元检测题
- 下一篇:必修一第一章综合练习