必修1第三章《金属及其化学性质》测试
http://www.newdu.com 2025/12/02 03:12:17 人民教育出版社 佚名 参加讨论
必修1第三章《金属及其化学性质》测试 广东省梅州市平远县平远中学 李春燕 满分100,考试时间45分钟。 H = 1 C = 12 N = 14 O = 16 Na = 23 Al = 27 Cl = 35.5 K = 39 Ca = 40 Fe = 56 Cu = 64 第一卷(选择题,共57分 ) 一.选择题:(本题有8个小题,每小题只有一个选项符合题意,每小题3分,共39分。) 1、自然界里常见金属元素存在最多的是Al,其次是铁,接着是铜。然而人类冶炼金属获得成功最早的反而是含量少的铜,含量最多的铝最迟冶炼出来,究其原因,合理的是( ) 。 A.矿石在地下埋藏,铜矿最浅,容易开发,铝矿埋得深,难开发 B.铜矿颜色较深,易发现,铝矿颜色较浅,不易发现 C.铜矿较易还原,铝矿很难还原 D.以上说法是错误的 2、设NA表示阿伏加德罗常数,下列叙述中正确的是( )。 A. 常温常压下,11.2 L氧气所含的原子数为NA B. 标准壮况下,1.12 L氦气所含的原子数为0.1NA C. 1.8 g NH4+离子中含有的电子数为NA D. 15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA 3、用于飞机制造的材料应具备强度高、密度小、质地轻的特点。以波音747为例,机身每减轻1 kg,因油耗降低,一年可获利2000美元。下列材料中哪种可用于飞机制造业( )。 A.Li-Al合金 B. 黄铜(Cu-Zn合金) C.Na-K合金 D. 生铁(Fe-C合金) 4、钠与水反应的现象和钠的下列性质无关的是( )。C A.钠的熔点较低 B.钠的密度小于水 C.钠的硬度较小 D.钠的还原性强 5、下列灭火剂能用于扑灭金属钠着火的是( )。 A.干冰灭火剂 B.黄沙 C.干粉灭火剂 D.泡沫灭火剂 6、下列离子在溶液中能大量共存的是( )。 A. Na+、CO32-、SO42-、H+ B. K+、AlO2-、H+、Cl- C. Fe2+、K+、H+、NO3- D. Al3+、H+、NO3-、SO42- 7、下列离子方程式正确的是( )。 A. 铁与稀硫酸反应:Fe+2H+===Fe3++H2↑ B. 氢氧化铝与足量盐酸反应:Al(OH)3+3H+===Al3++3H2O C.钠跟冷水反应:Na+2H2O= Na+ +2OH- + H2↑ D. 铜片与稀硝酸反应: Cu+ NO3-+4H+===Cu2++NO↑+2H2O 8、把7.4 g Na2CO3·10H2O和NaHCO3组成的固体混合物溶于水配成100 mL溶液,其中c(Na+)==0.6 mol·L-1。若把等质量的固体混合物加热至恒重,残留固体的质量是( )。 A. 3.18 g B. 2.12 g C. 4.22 g D. 5.28 g 9、取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为( )。 A.1:1 B.2:3 C.3:2 D.1:6 10、下列各组溶液,不另加其他试剂就可以将它们分别开的是( )。 A.NaCl、HCl、NaAlO2、NaHCO3 B.NaSO4、KNO3、(NH4)2SO4、MgCl2 C.FeCl3、NaOH、AlCl3、HNO3 D.AgNO3、NaCl、NaSO4、NaI 11、某溶液中,滴加KSCN溶液时无明显现象发生,再滴入少量氯水,溶液立即显红色。则原溶液中一定含有的是( )。 A.Fe2+ B.Fe3+ C.K+ D.NH4+ 12、为了除去FeCl2溶液中混有的少量FeCl3,最好的方法是向此溶液中( )。 A.通入氯气 B.加入Zn C.加入Fe D.加入Cu 13、把等量金属钠进行下列实验,其中生成氢气最多的是( )。 A.把钠放入足量稀盐酸中 B.把钠放入足量水中 C.把钠放入硫酸铜溶液中 D.将钠用铝箔包好并刺些小孔,再放入水中 二.选择题:(本题有6个小题,每小题有1或2个选项符合题意,每小题3分,共18分。)14、下列说法中,有错误的是( )。 A.Na2CO3溶液能与石灰水反应,而NaHCO3溶液不能与石灰水反应 B.NaHCO3比Na2CO3容易溶解于水 C.Na2CO3很稳定,而NaHCO3受热时容易分解 D.将等物质的量的NaHCO3粉末与Na2CO3粉末同时分别倒入适量的相同浓度的稀盐酸中,前者的反应更剧烈 15、按下图装置持续通人气体x,并在管口P处点燃,实验结果使澄清石灰水变浑浊,则X、Y可能是( )。  A.H2和NaHCO3 B.CO和Na2CO3 C.CO和CuO D.H2和Fe2O3 16、某溶液含有较多的Na2SO4和少量的Fe2(SO4)3,若用该溶液制取芒硝(Na2SO4·10H2O),可供选择的操作有:①加适量H2SO4溶液;②加金属Na;③结晶;④加过量NaOH溶液;⑤加强热脱结晶水;⑥过滤。正确的操作步骤是( )。 A. ②⑥③ B. ④⑥①③ C. ④⑥③⑤ D.②⑥①③⑤ 17、将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状态下得到混合气体,再将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为( )。 A. 2:1:1 B. 1:1:2 C. 1:2:1 D. 4:3:2 18.把铁片加到1 L 1 mol/L的氯化铁溶液中,当反应后溶液中Fe3+和Fe2+物质的量浓度相等时,铁片减少的质量为( )。 A 2.8 g B 5.6 g C 11.2 g D 1.4 g 19、制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是烧杯中 ( )。 A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无 第二部分((非选择题,共43分) 三.(本题包括4小题,共26分。) 20、(3分)通常用小苏打的悬浊液除去CO2中的HCl,该反应的离子方程式为_________,不能用NaOH溶液的原因是_____________,也不能用NaCO3的原因是_________________________(用离子方程式表示原因)。 21、(5分)“比较”是化学研究物质性质的基本方法之一,请运用比较法解答下列问题:已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。如: 2Na2O2+2CO2=2Na2CO3+O2, Na2O2+CO=Na2CO3。 (1)试分别写出Na2O2与SO2、SO3反应的化学方程式。 (2)通过比较可知:在氧化物中,当非金属元素处于 价时,其氧化物与过氧化钠反应就有O2 生成。 22、(2分)200℃时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体的质量增加了3.6 g ,则原混合气体中CO2和水蒸气的质量比 。 23.(3分)某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在一支试管中滴入酸性高锰酸钾溶液,在另一支试管中滴入KSCN溶液。请你填出该同学实验中出现以下现象时的应得出结论:
24.(7分)右边图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色反应均为黄色。 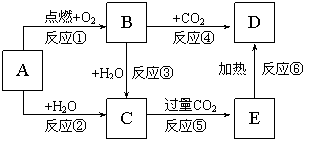 请填写下列空白: (1)写出化学式: A 、B 、 C 、D 。 (2)以上反应中属于氧化还原反应的有 。(填写编号) (3)写出A → C反应的离子方程式 ;E → D的化学方程式 。 25、(7分)下列物质之间有如下反应关系: 已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。 回答:(1) 写出下列物质的化学式: A B D 甲 乙 丙 (2) 写出E→C反应的化学方程式: 。 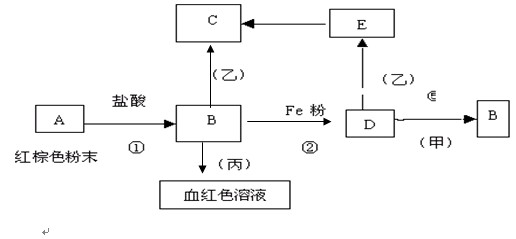 四、计算题(16分) 26、(6分)3.84 g Fe和Fe2O3的混合物溶于120 mL的盐酸,刚好完全反应。生成0.03 mol H2,向反应后的溶液中加入KSCN检验,溶液不显色。试求: (1)原混合物中Fe2O3和Fe的质量分别为多少。 (2)原盐酸的物质的量浓度。 27、(10分)向20 mL AlCl3溶液中滴入2 mol/L NaOH溶液时,得到沉淀的质量与所滴加NaOH溶液的体积有如图关系:  (1)图中A点表示的意义是 。 (2)图中B点表示的意义是 。 (3)若溶液中有Al(OH)3沉淀0.39 g,求出用去NaOH溶液的体积。 参考答案:
20、HCO3- + H+ = H2O+ CO2 ↑ CO2 + 2OH- = H2O+ CO32- H2O+ CO32- + CO2=2 HCO3- 21、(1)SO2+Na2O2=Na2SO4 2SO3+2Na2O2=2Na2SO4+O2(2)2 (3)最高 22、1∶18 。 23、(1)没有被氧化;(2)完全被氧化:(3)部分被氧化。 24、(1)Na Na2O2 NaOH Na2CO3 (2)①②④ (3)2Na + 2H2O = 2Na+ + 2OH- + H2 2NaHCO3 = Na2CO3 + CO2 + H2O 25、A Fe2O3 B FeCl3 D FeCl2 甲 Cl2 乙 NaOH 丙 KSCN (各1分,共6分) (2)、写出E→C反应的化学方程式: 4Fe(OH)2 +O2 + 2H2O = 4Fe(OH)3 (2分) 26、(1)Fe:2.24 g Fe2O3:1.6 g (2)1 mol·L-1 27、(1)Al3+完全沉淀;(2)Al(OH)3刚好完全溶解;(3)7.5 mL或17.5 mL。 (责任编辑:admin) |
- 上一篇:《钠的化合物 》测试
- 下一篇:化学计量在实验中的应用——物质的量(一)