河北省宣化县第一中学2012~2013学年第一学期高二期末考试试卷化学试题
http://www.newdu.com 2025/12/16 06:12:35 人民教育出版社 佚名 参加讨论
河北省宣化县第一中学2012~2013学年第一学期高二期末考试试卷化学试题 河北省宣化县第一中学 栾春武 河北省宣化县第一中学2012~2013学年第一学期高二期末考试试卷 化 学 (理 科)(选修4) 可能用到的相对原子质量: H 1,C 12,N 14,O 16,S 32, Cl 35.5,Na 23 ,K 39,Al 27,Fe 56,Zn 65,Cu 64 第Ⅰ卷(选择题,共55分) 一、选择题(本题包括20个小题,每小题2分,共40分。每小题只有一个选项符合题意) 1.下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa): ①C4H10(g)+O2(g)===4CO2(g)+5H2O(l) ΔH=-2878 kJ·mol?1 ②C4H10(g)+O2(g)===4CO2(g)+5H2O(g) ΔH=-2658 kJ·mol?1 ③C4H10(g)+O2(g)===4CO(g)+5H2O(l) ΔH=-1746 kJ·mol?1 ④C4H10(g)+O2(g)===4CO(g)+5H2O(g) ΔH=-1526 kJ·mol?1 由此判断,正丁烷燃烧热ΔH是 A.-2878 kJ·mol?1 B.-2658 kJ·mol?1 C.-1746 kJ·mol?1 D.-1526 kJ·mol?1 2.关于强、弱电解质的叙述不正确的是 A.强电解质在水溶液中完全电离 B.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 C.同一弱电解质相同物质的量浓度的溶液,温度不同时,导电能力不同 D.强电解质在固态或液态时,可能不导电 3.反应2A(g) A.加压 B.减压 C.减小E的浓度 D.降温 4.沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2气体和液态H2O时,放出445kJ热量,则下列热化学方程式中正确的是 A.CH4(g)+2O2(g) == CO2(g)+2H2O(g) ΔH== ?890kJ·mol?1 B.CH4(g)+2O2(g) == CO2(g)+2H2O( l ) ΔH== +890kJ·mol?1 C.CH4(g)+2O2(g) == CO2(g)+2H2O( l ) ΔH== ?890kJ·mol?1 D.CH4(g)+O2(g) == CO2(g)+H2O( l ) ΔH== ?890kJ·mol?1 5.有三支试管,分别盛有下列物质,观察这三支试管的颜色,其中颜色最浅的是 甲:10mL 0.01mol·L-1 FeCl3溶液 和10 mL 0.01 mol·L-1 KSCN溶液 乙:5mL水和10mL 0.01mol·L-1 FeCl3溶液和5mL 0.01mol·L-1 KSCN溶液 丙:10mL 0.1mol·L-1 FeCl3溶液 和10mL 0.1mol·L-1 KSCN溶液 A.甲试管 B.乙试管 C.丙试管 D.无法判断 6.将常温下pH=12的氢氧化钠溶液与pH=2的硫酸溶液分别加热,溶液pH的变化是 A.前者减小后者不变 B.前者减小后者增大 C.都不变 D.都减小 7.下列不能减慢锌与稀盐酸的反应速率的措施是 A.降低温度 B.加入氯化钠溶液 C.加入少量CH3COONa固体 D.增大锌的用量 8.液氨与水相似,存在着微弱的电离:2NH3 A.此温度下,液氨的离子积等于1×10?30 B.在液氨中放入NaNH2,则液氨的离子积数值将增大 C.此温度下,在液氨中加入NaNH2,则液氨中c(NH4+)<1×10?15 mol·L?1 D.在液氨中加入NH4Cl,则液氨中c(NH4+)将大于c(NH2?) 9.如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是  A.外电路的电流方向为:X→导线→Y B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe C.X极上发生的是还原反应,Y极上发生的是氧化反应 D.若两电极都是金属,则它们的活动性顺序为X>Y 10.下列说法正确的是 A.凡是放热反应都是自发的,吸热反应都是非自发的 B.自发反应一定是熵增大,非自发反应一定是熵减少或不变 C.自发反应在任何条件下都能实现 D.自发反应在恰当条件下才能实现 11.下列有关说法,正确的是 A.电解质溶于水一定放出热量 B.在一个确定的化学反应中,反应物总能量总是高于生成物总能量 C.可逆反应在加热时正逆反应速率都增大 D.25℃时,0.01 mol·L?1的氢氧化钠溶液中,水电离的c(H+)与水电离的c(OH-)的乘积为10?14 12.在恒温恒容的密闭容器中,发生反应X(g)+2Y(g) ①X、Y、Z的物质的量之比为1: 2 : 2 ②X、Y、Z的浓度不再发生变化 ③容器中气体的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol X A.①② B.①④ C.②③ D.③④ 13.在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是 A.反应达到平衡时,X的转化率为50% B.增大压强,使平衡向生成Z的方向移动,平衡常数增大 C.反应可表示为X+3Y D.改变温度可以改变此反应的平衡常数 14.25℃时,由水电离出的c(H+)= 1×10-13mol·L-1的溶液中,一定不能大量共存的离子组是 ① K+、Al3+、Cl-、CO32- ② K+、Fe3+、I-、SO42- ③ Fe2+、Cl-、NO3-、SO42- ④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3- A.②③④ B.②③④⑤ C.①②③④ D.②④ 15.高温下,某反应达到平衡,平衡常数K=。恒容时,温度升高,H2浓度减小。下列说法正确的是 A.该反应的焓变为负值 B.缩小容器体积,平衡不移动,H2浓度一定增大 C.升高温度,正反应速率增大,逆反应速率减小 D.该反应化学方程式为CO+H2O 16.下列液体混合后,常温下溶液一定呈碱性的是 A.pH=12的氢氧化钠溶液与pH=2的某酸溶液等体积混合 B.pH=6的盐酸溶液1mL与999mL水混合 C.pH=2的盐酸与0.01 mol·L?1的氨水等体积混合 D.1×10?3 mol·L?1的盐酸和6×10?4 mol·L?1的Ba(OH)2溶液各取10mL,混合后再稀释100倍 17.下列有关实验操作的叙述正确的是 A.中和滴定实验中指示剂不宜加入过多,通常控制量在1 mL ~2mL B.用50mL酸式滴定管可准确量取25.00mLKMnO4 溶液 C.用量筒量取5.00mL1.00mol·L-1 盐酸 D.中和滴定实验中的锥形瓶用待测液润洗 18.可以将反应Zn+Br2 ①Br2+2e?==2Br? ②2Br??2e?== Br2 ③Zn?2e?==Zn2+ ④Zn2+ +2e?== Zn 其中表示充电时的阳极反应和放电时的负极反应的分别是 A.②和③ B.②和① C.③和① D.④和① 19.已知甲、乙、丙、丁代表4种纯净物。甲(g)+2乙(g) A.甲(g)的能量一定大于丙(g)的能量 B.该反应不需要加热 C.1 mol甲(g)与2 mol乙(g)的总能量高于1 mol丙(g)和1 mol丁(g)的总能量 D.在一密闭容器中充入1 mol 甲(g)与2 mol 乙(g),在一定条件下反应放出的热量为a kJ 20.下列离子方程式书写正确的是 A.Na2S的水解:S2-+ 2H2O B.NaHCO3在水溶液中的电离:HCO3?+ H2O C.NH4Cl的水解:NH4+ + H2O D.硫酸铝溶液和碳酸氢钠溶液混合: Al3+ + 3HCO3? = Al(OH)3↓+3CO2↑ 二、选择题(本题包括5个小题,每小题3分,共15分。每小题只有一个选项符合题意。) 21.已知C2H4(g)和C2H5OH(l)的燃烧热ΔH分别是?1411.0kJ·mol?1和?1366.8kJ·mol?1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为 A.?44.2kJ·mol?1 B.+44.2kJ·mol?1 C.?330kJ·mol?1 D.+330kJ·mol?1 22.某溶液中只含有Na+、H+、OH?、A?四种离子,下列说法不正确的是 A.若溶液中c(A?)=c(Na+),则溶液一定呈中性 B.溶液中可能存在:c(Na+)> c(A?)> c(OH?)> c(H+) C.若c(OH?)> c(H+),溶液中可能存在:c(Na+)> c(OH?) > c(A?)> c(H+) D.若溶质为NaA、HA,则一定存在:c(A?) > c(Na+)> c(H+) > c(OH?)  23.如图所示,两极上发生的反应:a极Cu2++2e?=Cu;b极Fe ?2e?=Fe2+,下列说法不正确的是 A.装置中电解质溶液一定含有Cu2+ B.该装置可能是将化学能转化为电能的装置 C.a极上发生氧化反应 D.a、b可能是同种电极材料 24.将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是    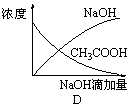 25.右图表示可逆反应A(s)+B(g)  A.若条件为催化剂,则a表示有催化剂,b表示没有催化剂 B.只改变温度,则a比b的温度高,且Q>0 C.只改变压强,则a比b的压强大,n>2 D.由图象可以作出判断,反应一定从正反应方向开始 第Ⅱ卷(非选择题,共45分) 三、填空题(本题包括5个小题,共45分) 26.(6分) (1)已知室温下BaSO4的Ksp =1.1×10?10,欲使溶液中c(SO42-)≤1.0×10?6 mol·L?1,应保持溶液中c(Ba2+)≥ 。 (2)向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,反应的离子方程式为 (3)25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol·L?1的醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。 下列有关溶液中离子浓度关系的叙述正确的是 。(错选不得分) 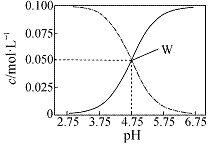 A.pH=5.5的溶液中: c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) B.W 点所表示的溶液中: c(Na+)+c(H+)= c(CH3COOH)+c(OH-) C.pH = 3.5的溶液中: c(Na+) +c(H+) ?c(OH-) +c(CH3COOH)= 0.1mol·L?1 D.向W点所表示的1.0 L 溶液中通入0.05 mol HCl 气体(溶液体积变化可忽略): c(H+)= c(CH3COOH)+c(OH-) 27.(8分) (1)肼(N2H4)是一种可燃性的液体,在氧气中完全燃烧生成氮气和水。肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时: ①正极的电极反应是 ②负极的电极反应是 (2)如图是一个电化学过程示意图。  ①锌片上发生的电极反应是 ②假设使用肼—空气燃料电池作为电源,铜片的质量减少128g,则肼—空气燃料电池理论上消耗标准状况下的空气 L (假设空气中氧气体积分数为20%)。 28.(12分)在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)
(1)写出该反应的平衡常数表达式:K= 。 (2)右图中表示NO2的变化的曲线是 。  (3)用O2表示从0~2s内该反应的平均速率υ= 。 (4)能说明该反应已达到平衡状态的是 。 a.υ(NO2)=2 υ(O2) b.容器内压强保持不变 c.υ逆(NO)=2 υ正(O2) d.容器内密度保持不变 (5)某同学查阅资料得知,该反应的平衡常数K(300℃)>K(350℃);25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“?”。根据题目信息,该反应的热化学方程式为 。 (6)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。 a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂 29.(12分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,请填写下列空白: (1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250mL (填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。 (2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数填写在横线上。 MnO4-+ H2O2+ H+= Mn2++ H2O+ O2↑ (3)滴定时,将高锰酸钾标准溶液注入 (填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是 。 (4)重复滴定三次,平均耗用c mol·L?1 KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为 。 (5)下列操作能使测定结果偏高的是 。(错选不得分) A.滴定前滴定管尖嘴中有气泡,滴定后气泡消失。 B.读取高锰酸钾标准溶液的体积时,滴定前平视,滴定后俯视。 C.滴定前,在用蒸馏水洗涤滴定管后,未用高锰酸钾标准液润洗。 D.滴定过程中,锥形瓶中部分溶液溅出 30.(7分)直接排放含SO2 的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2,在钠碱循环法中,Na2SO3溶液作为吸收液。吸收液吸收SO2的过程中,混合溶液的pH随n(SO32? ) : n(HSO3?) 变化关系如下表:
(1)据上表判断NaHSO3溶液显 性(填酸、碱、中),用化学平衡原理解释(要有必要的离子方程式) 。 (2)当吸收液呈中性时,溶液中离子浓度由大到小的顺序为: 。 (3)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:  HSO3?在阳极放电的电极反应式是 。 期末考试高二化学(理科)参考答案及评分标准
26.(6分,每空2分) (1)1.1×10?4 mol·L?1(不带单位不得分)(2)2AgC1+S2? =Ag2S +2C1? (3)BC(少选得1分,错选不得分) 27.(8分,每空2分)(1)O2+2H2O+4e?= 4OH? N2H4+4OH??4e?= 4H2O+N2 (2)①Cu2++2e?== Cu ② 112 28.(12分,每空2分) (1) 或 (2)b (3)1.5×10?3mol·L-1·s-1 (4)b c(少选得1分,错选不得分) (5)2NO(g)+O2(g) 29.(12分,每空2分) (1)容量瓶 (2)2 5 6 2 8 5 (3)酸式 滴入一滴高锰酸钾溶液,溶液变为浅红色,且30秒内不褪色 (4) 或% (5)AC(少选得1分,错选不得分) 30.(7分) (1)酸(1分)在NaHSO3溶液中存在:HSO3? (2)c(Na+ )> c(HSO3?)> c(SO32?)> c(H+)= c(OH?) (2分) (3)HSO3?+H2O?2e?== SO42?+3H+ (2分) (责任编辑:admin) |
- 上一篇:第一章 从实验学化学 测试
- 下一篇:化学计量在实验中的应用 同步测试