第一章 从实验学化学 测试
http://www.newdu.com 2025/12/02 02:12:35 人民教育出版社 佚名 参加讨论
第一章 从实验学化学 测试 湖南湘乡四中 龙 威 一、选择题 1.每摩尔物质含有( )。 A. 6.02×1023个分子 B. 6.02×1023个原子 C. 阿伏加德罗常数个原子 D. 阿伏加德罗常数个该物质的粒子 2.下列说正确的是( )。 A.物质的量就是1摩尔物质的质量 B.1 mol水中含有2 mol氢和1 mol氧 C.1 mol气态水比1 mol液态水所含的分子数多 D.3 mol O2 与2 mol H2O中原子数相等 3.设NA代表阿伏加德罗常数,下列说法不正确的是( )。 A.14 g氮气所含原子数为NA B.1 mol 水中所含电子数为10NA C.32 g O2与32 g O3所含原子数分别为2NA和3NA D.0.5 mol Na2CO3与1.5 mol H2O所含氧原子数目均为1.5NA 4.下列说法正确的是( )。 A.6.02×1023个碳原子的质量为1 g B.钠原子的摩尔质量为23 g C.HCl的摩尔质量等于6.02×1023个HCl分子的质量 D.Na2O2的摩尔质量为78 g/mol 5.在0.25 mol Na2O中,含有的氧离子数约为( )。 A. 1个 B. 0.25个 C. 1.5×1023个 D. 6.02×1023个 6.在一定量的NaHCO3中,氧原子与氢原子的物质的量之比是( )。 A. 1:1 B. 1:3 C. 3:1 D. 2:3 7.下列叙述正确的是( )。 A. 氢氧化钠的摩尔质量是40 g B. 1 mol NaOH的质量是40 g/mol C. 1 g H2和1 g N2所含分子数相等 D. 等质量的N2.CH4.CO.H2O中CH4所含分子数最多 8.下列物质中,含有0.4 mol氯离子的是( )。 A. 0.4 mol KClO3 B. 4/30 mol FeCl3 C. 3/40 mol FeCl3 D. 0.1 mol KCl 9.下列表述或叙述中,正确的是( )。 A.1 mol氢 B.3 mol H2 C.2 mol氢分子 D.1 mol H 10.已知a mol H2和b mol H2O中所含的原子个数相等,则a:b的值为( )。 A.1:1 B.1:3 C.3:2 D.任意比 11.一定量的氧气中含有1 mol电子,这些氧气的物质的量为( )。 A.1 mol B.0.5 mol C.0.125 mol D.0.0625 mol 12.已知3.2 g某气体中含有3.01×1022个分子,此气体的摩尔质量是( )。 A.32 g/mol B. 64 C. 64 g/mol D. 4 g 13.质量比为1:2的H2SO4和H3PO4,氢原子物质的量之比为( )。 A. 1:2 B. 1:3 C. 2:1 D. 3:4 14. 相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )。 ①它们所含的分子数目之比为1∶1; ②它们所含的O原子数目之比为1∶2; ③它们所含的原子总数目之比为2∶3; ④它们所含的C原子数目之比为1∶1;⑤它们所含的电子数目之比为7∶11 A.①②③④ B.②和③ C.④和⑤ D.①②③④⑤ 15.把0.5 mol Na和0.5 mol Mg分别投入到过量的m1 g水和m2 g盐酸中,分别得到溶液a和b。若m1=m2,则a与b的质量关系是( )。 A.ma>mb B.ma<mb C.ma=mb D.无法确定 16.足量的镁、锌、铁与含等物质的量HCl的稀盐酸反应,下列图象正确的是( )。 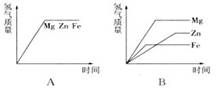 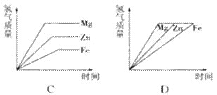 17.铜的摩尔质量为M g/mol,密度为d g/cm3,阿伏加德罗常数为NA,下列说法正确的是( )。 A.1 kg铜所含原子的数目为d NA B.一个铜原子所占有的体积为(M/d)NA cm3 C.一个铜原子的质量为M/NA g D.1 dm3铜所含有的原子数为 d NA/M 18.已知32 g X与40 g Y恰好完全反应,生成m g Q和9 g H。在相同条件下,16 g X和30 g Y混合反应生成0.25 mol Q及若干摩尔H。则物质Q的摩尔质量应是( )。 A.63 g/mol B.122 g/mol C.126 g/mol D.163 g/mol 19.在反应3Cl2+6NaOH=NaClO3+5NaCl+3H2O中,当有m g Cl2被氧化时,被还原的氯气是( )。 A.3m g B. 5m g C. 6m/35.5 mol D. 5m/71 mol 二、填空题 1.摩尔是表示 的单位,每摩尔物质均含有 个粒子。12g 12C中含有的碳原子数约为 个,1 mol H2O分子约含有 个电子,9 g H2O含有 mol电子。 2. 49 g磷酸(H3PO4)中有 mol H3PO4分子,含有 mol原子,与 g氢氧化钠恰好完全反应生成正盐。 3.等质量的碳酸钠与碳酸氢钠,分别与过量的盐酸反应时,产生的二氧化碳的物质的量之比是 。等物质的量的碳酸钠与碳酸氢钠与过量的盐酸反应时,消耗的HCl的物质的量之比是 ,产生的二氧化碳的质量比是 。 4.NO2的相对分子质量为a,NO的相对分子质量为b,则N2O的摩尔质量为(用a.b表示) 三、计算题 1.已知一个氧原子的质量为2.657×10-26kg,则多少克氧气的物质的量为1mol?(要求根据氧原子的质量进行推算) 2.与171 g Al2(SO4)3中所含的SO42-数目相同的Na2SO4的质量是多少?将171 g Al2(SO4)3和142 g Na2SO4混合,其混合物的平均摩尔质量是多少? 3.有CO与CO2的混合气体共33.6 L,其密度为1.726 g/L,已知混合气体共有9.03×1023个分子,则该混合气体的平均摩尔质量是多少?CO与CO2的分子个数比是多少? 4.在Al2(SO4)3和MgSO4组成的混合物中,Al3+与Mg2+的物质的量之比为2∶3,则在含有2 mol SO 参考答案及解析 一、选择题 1.D 提示:摩尔是物质的量的单位,物质的量研究的对象是各种微粒,包括原子.分子.离子.质子.中子.电子等,所以A.B.C说法不完整,故D正确。 2.D 提示:物质的量是一定数目微粒的集体,与质量是不同的物理量,所以A错误。用摩尔表示物质的量时,应该用化学式指明粒子的种类,B选项中氢与氧表示的是元素种类,而不是粒子的种类,所以B错误。物质的量是一定数目微粒的集体,而物质微粒数目的多少与物质的状态无关,所以C选项中二者分子数目应相等。D选项中3 mol O2含6 mol 氧原子,2 mol H2O中含4mol 氢原子和2 mol氧原子,共6 mol原子,所以D正确。 3.C提示:一个水分子是由两个氢原子和一个氧原子构成的,而一个氢原子含1个电子,一个氧原子含8个电子,所以一个水分子含10个电子,即1 mol水中所含电子数为10 mol,即10NA,所以B正确。 4.D 提示:C选项中混淆了摩尔质量与质量这两个概念,摩尔质量与质量意义不同,单位也不相同,质量以g为单位,摩尔质量以g/mol为单位,1 mol物质的质量与该物质的摩尔质量只是在数值上相等,选项C错误。 5.C 6.C 7.D 提示:根据N=n×NA,即物质的微粒个数之比等于物质的量之比,C选项中1g H2和1 g N2的物质的量分别为0.5 mol和1/28 mol,所以分子数不相等。D选项中等质量的N2.CH4.CO.H2O中,先假设质量都为1g,则其物质的量分别为1/28 mol.1/16 mol.1/28 mol.1/18 mol,所以CH4的物质的量最大,其分子数最多。 8.B 提示:KClO3是由钾离子与氯酸根离子形成的离子化合物,其中不含氯离子。 9.BD 提示:物质的量对应的微粒要具体,且要用化学语言。 10.C 11.D 12.C 提示:根据n=N÷NA,所以n=3.01×1022÷6.02×1023 mol-1=0.05 mol 再由M=m÷n=3.2g÷0.05 mol=64 g/mol 13.B 提示:H2SO4和H3PO4的摩尔质量都是98 g/mol。根据n=m/M知,当摩尔质量相等时,其质量比就等于其物质的量之比,所以H2SO4和H3PO4的物质的量之比也为1:2,而1 mol H2SO4中含2 mol的氢原子,1 mol H3PO4中含3 mol的氢原子,所以其氢原子的物质的量之比是2:6=1:3。 14.D 15. C 提示:由于水和盐酸均过量,所以放出氢气的量要根据金属单质来算。根据化学方程式2Na+2H2O=2NaOH+H2↑.Mg+2HCl=MgCl2+H2↑可求得ma=mb。 16.D 提示:镁.锌.铁的金属活动性依次减弱,因此与盐酸反应的速率也依次减小,反映在图象中斜线的斜率也依次减小。由于金属是足量的,金属与盐酸反应会随着盐酸逐渐耗尽而反应停止,因此,最终产生氢气的质量取决于盐酸的质量。因为与含等质量HCl的盐酸反应,所以最终生成氢气的质量相等。 17.C 提示:1 kg铜物质的量为1000/M mol,所以含原子数为1000NA/M,故A错。1 mol铜的体积是M/d,1个铜原子所占有的体积为(M/d)/NA cm3,所以B错。1 mol铜的质量为M g,含NA个铜原子,1个铜原子的质量为M/NA g,即C正确。1dm3铜的质量是1000d g,铜的物质的量为1000d/M mol,所以含原子数目为1000dNA/M,即D错。 18.C 提示:由“32g X与40g Y恰好完全反应,生成m g Q和9 g H”和质量守恒定律可知,32 g +40 g =m+9 g,即m=63。32 g X与40 g Y恰好反应生成63 g Q,则16 g X能与20 g Y反应生成31.5g Q,可见,Y过量。又因为生成的Q为0.25 mol,即得M=m/n=31.5 g/0.25 mol=126 g/mol。 19.BD 二、填空题 1. 物质的量 阿伏加德罗常数 6.02×1023 6.02×1024 5 2. 0.5 4 60 3.42:53 2:1 1:1 4.(3b-a)g/mol 提示:NO2在组成上比NO多一个氧原子,所以(a-b)为氧的相对原子质量。由于NO的相对分子质量为b,则N的相对原子质量为[b-(a-b)]=(2b-a),所以N2O的相对分子质量为[2(2b-a)+(a-b)]=(3b-a)。 三、计算题 1.32g 提示:因为1个氧分子含2个氧原子,1 mol O2约含6.02×1023个氧分子,所以有:2.657×10-26kg×2×6.02×1023=31.99×10-3kg=32.0 g。 2. 213g 208 67 g/mol 解析:(1)n[Al2(SO4)3]=m/M=171 g÷342 g/mol=0.5 mol n(SO42-)=3×n[Al2(SO4)3]=3×0.5 mol=1.5 mol m(Na2SO4)=1.5 mol×142 g/mol=213 g (2) n[Al2(SO4)3]= m/M= 171 g÷342 g/mol=0.5 mol n(Na2SO4)= m/M=142 g÷142 g/mol=1 mol M(平均)= =(171 g+142 g)÷(0.5 mol+1 mol)=208.67 g/mol 3.38 67 g/mol;1:2 提示:m(总)=1.726g/L×33.6L=58g n(总)=N÷NA=9.03×1023÷6.02×1023mol-1=1.5mol M(平均)=m(总)÷n(总)=58 g÷1.5mol=38.67g/mol 又因为m(总)=[28n(CO)+44n(CO2)]g .n(总)= [n(CO)+ n(CO2)]mol 所以有:M(平均)=m(总)÷n(总)=[ 28n(CO)+44n(CO2)]÷[n(CO)+ n(CO2)]mol=38.67g/mol 解得:n(CO): n(CO2)= 1:2 4.120 g 提示:首先将Al3+与Mg2+的物质的量之比转化为Al2(SO4)3与MgSO4的物质的量之比。 其次利用守恒关系,求出含2 mol SO 的混合物中MgSO4的物质的量。 1 mol Al2(SO4)3含3 mol SO 3 mol MgSO4 含3 mol SO 故含2 mol SO 最后利用MgSO4的摩尔质量求算其质量:m(MgSO4)=1 mol×120 g/mol=120 g。 (责任编辑:admin) |