高中化学氢氧化亚铁制备的实验改进设计
因Fe(OH)2在空气中易氧化,4Fe(OH)2+O2+2H2O=4Fe(OH)3,故Fe(OH)2在水中稳定存在的寿命只有几秒钟,在实验室制取Fe(OH)2时,一定要用新制的Fe2+盐和先加热驱赶O2后的NaOH溶液,且滴管末端插入试管内的液面下,再滴加NaOH溶液,也可以在反应液面上滴加植物油或苯等物质进行液封,以减少Fe(OH)2与O2接触。
例 根据下述实验装置和操作,回答有关问题.
按图中所示装置,用两种不同操作分别进行实验,观察B管中现象.
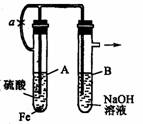
(1)操作1:先夹紧止水夹a,再使A管开始反应.实验中在B管中观察到的现象是:_____________________________________________。
B管中发生反应的离子方程式是:____________________________。
(2)操作2:打开止水夹a,使A管开始反应一段时间后再来夹紧止水夹a.实验中在B管中观察到的现象是:____________________________________________________。
B管中发生反应的离子方程式是:_____________________________________。
(3)请说明造成两种操作现象不同的原因,(若两种现象相同,此小题不需要回答)______________________________________________。
【解析】当加紧止水夹a使A试管进行反应时,产生的气体会将稀H2SO4和生成的FeSO4压入B管内,与适量的NaOH反应生成Fe(OH)2沉淀,但由于系统中含有空气,生成的Fe(OH)2即被氧化为Fe(OH)3,出现一系列的颜色变化。当先使A管内反应一段时间后再关闭止水夹,由于产生的氢气将系统中的空气赶紧,使生成的Fe(OH)2不再被氧化。
【答案】(1)液面上升,生成白色沉淀,迅速变成灰绿色,最后变成红褐色。
方程式: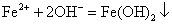 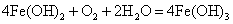
(2)液面上升,生成白色沉淀;: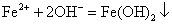
(3)操作1没有排出B试管中的空气,而操作2产生的氢气使试管中空气排出,防止Fe(OH)2被氧化为Fe(OH)3.
【思维启示】关于Fe(OH)2制备的方法很多,核心问题两点,一是溶液中的溶解氧必须除去,二是反应过程必须与O2隔绝。
(责任编辑:admin)
|
