高二新学期化学预习·选修四第三章知识点总结
http://www.newdu.com 2025/12/02 10:12:21 三好网 佚名 参加讨论
对于高二新生来说,掌握高中化学选修4的知识点,对于化学成绩的提高有很大帮助,所以今天小编就整理了选修四第三章《水溶液中的离子平衡》,和大家一起预习高二化学选修4的知识点。  第三章水溶液中的离子平衡 一、弱电解质的电离 1、定义: 电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。 非电解质:在水溶液中或熔化状态下都不能导电的化合物。 强电解质:在水溶液里全部电离成离子的电解质。 弱电解质:在水溶液里只有一部分分子电离成离子的电解质。  2、电解质与非电解质本质区别: 电解质——离子化合物或共价化合物非电解质——共价化合物 注意:①电解质、非电解质都是化合物 ②SO2、NH3、CO2等属于非电解质 ③强电解质不等于易溶于水的化合物(如BaSO4不溶于水,但溶于水的BaSO4全部电离,故BaSO4为强电解质)——电解质的强弱与导电性、溶解性无关。 3、电离平衡:在一定的条件下,当电解质分子电离成离子的速率和离子结合成时,电离过程 就达到了平衡状态 ,这叫电离平衡。 4、影响电离平衡的因素: A、温度:电离一般吸热,升温有利于电离。 B、浓度:浓度越大,电离程度越小 ;溶液稀释时,电离平衡向着电离的方向移动。 C、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会减弱电离。 D、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。 9、电离方程式的书写:用可逆符号弱酸的电离要分布写(第一步为主) 10、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。叫做电离平衡常数,(一般用Ka表示酸,Kb表示碱。 ) 表示方法:ABA++B- Ki=[ A+][ B-]/[AB] 11、影响因素: a、电离常数的大小主要由物质的本性决定。 b、电离常数受温度变化影响,不受浓度变化影响,在室温下一般变化不大。 C、同一温度下,不同弱酸,电离常数越大,其电离程度越大,酸性越强。如:H2SO3>;H3PO4>;HF>;CH3COOH>;H2CO3>;H2S>;HClO 二、水的电离和溶液的酸碱性 1、水电离平衡: 水的离子积:KW = c[H+]·c[OH-] 25℃时, [H+]=[OH-] =10-7 mol/L ; KW = [H+]·[OH-] = 1*10-14注意:KW只与温度有关,温度一定,则KW值一定 KW不仅适用于纯水,适用于任何溶液(酸、碱、盐) 2、水电离特点: (1)可逆 (2)吸热 (3)极弱 3、影响水电离平衡的外界因素: ①酸、碱 :抑制水的电离 KW〈1*10-14 ②温度:促进水的电离(水的电离是吸热的) ③易水解的盐:促进水的电离 KW 〉 1*10-14 4、溶液的酸碱性和pH: (1)pH=-lgc[H+] (2)pH的测定方法: 酸碱指示剂——甲基橙 、石蕊 、酚酞 。 变色范围:甲基橙 3.1~4.4(橙色)石蕊5.0~8.0(紫色)酚酞8.2~10.0(浅红色) pH试纸 —操作玻璃棒蘸取未知液体在试纸上,然后与标准比色卡对比即可 。 注意:①事先不能用水湿润PH试纸;②广泛pH试纸只能读取整数值或范围 三 、混合液的pH值计算方法公式 1、强酸与强酸的混合:(先求[H+]混:将两种酸中的H+离子物质的量相加除以总体积,再求其它) [H+]混 =([H+]1V1+[H+]2V2)/(V1+V2) 2、强碱与强碱的混合:(先求[OH-]混:将两种酸中的OH-离子物质的量相加除以总体积,再求其它) [OH-]混=([OH-]1V1+[OH-]2V2)/(V1+V2) (注意 :不能直接计算[H+]混) 3、强酸与强碱的混合:(先据H+ + OH- ==H2O计算余下的H+或OH-,①H+有余,则用余下的H+数除以溶液总体积求[H+]混;OH-有余,则用余下的OH-数除以溶液总体积求[OH-]混,再求其它) 四、稀释过程溶液pH值的变化规律: 1、强酸溶液:稀释10n倍时,pH稀=pH原+ n (但始终不能大于或等于7) 2、弱酸溶液:稀释10n倍时,pH稀〈pH原+n (但始终不能大于或等于7) 3、强碱溶液:稀释10n倍时,pH稀=pH原-n (但始终不能小于或等于7) 4、弱碱溶液:稀释10n倍时,pH稀〉pH原-n (但始终不能小于或等于7) 5、不论任何溶液,稀释时pH均是向7靠近(即向中性靠近);任何溶液无限稀释后pH均接近7 6、稀释时,弱酸、弱碱和水解的盐溶液的pH变化得慢,强酸、强碱变化得快。 五、强酸(pH1)强碱(pH2)混和计算规律w.w.w.k.s.5.u.c.o.m 1、若等体积混合 pH1+pH2=14则溶液显中性pH=7 pH1+pH2≥15则溶液显碱性pH=pH2-0.3 pH1+pH2≤13则溶液显酸性pH=pH1+0.3 2、若混合后显中性 pH1+pH2=14 V酸:V碱=1:1 pH1+pH2≠14 V酸:V碱=1:10〔14-(pH1+pH2)〕 六、酸碱中和滴定: 1、中和滴定的原理 实质:H++OH—=H2O即酸能提供的H+和碱能提供的OH-物质的量相等。 2、中和滴定的操作过程: (1)仪②滴定管的刻度,O刻度在上 ,往下刻度标数越来越大,全部容积大于它的最大刻度值,因为下端有一部分没有刻度。滴定时,所用溶液不得超过最低刻度,不得一次滴定使用两滴定管酸(或碱),也不得中途向滴定管中添加。②滴定管可以读到小数点后一位 。 (2)药品:标准液;待测液;指示剂。 (3)准备过程: 准备:检漏、洗涤、润洗、装液、赶气泡、调液面。(洗涤:用洗液洗→检漏:滴定管是否漏水→用水洗→用标准液洗(或待测液洗)→装溶液→排气泡→调液面→记数据V(始) (4)试验过程 3、酸碱中和滴定的误差分析 误差分析:利用n酸c酸V酸=n碱c碱V碱进行分析 式中:n——酸或碱中氢原子或氢氧根离子数;c——酸或碱的物质的量浓度; V——酸或碱溶液的体积。当用酸去滴定碱确定碱的浓度时,则: 上述公式在求算浓度时很方便,而在分析误差时起主要作用的是分子上的V酸的变化,因为在滴定过程中c酸为标准酸,其数值在理论上是不变的,若稀释了虽实际值变小,但体现的却是V酸的增大,导致c酸偏高;V碱同样也是一个定值,它是用标准的量器量好后注入锥形瓶中的,当在实际操作中碱液外溅,其实际值减小,但引起变化的却是标准酸用量的减少,即V酸减小,则c碱降低了;对于观察中出现的误差亦同样如此。综上所述,当用标准酸来测定碱的浓度时,c碱的误差与V酸的变化成正比,即当V酸的实测值大于理论值时,c碱偏高,反之偏低。 同理,用标准碱来滴定未知浓度的酸时亦然。 七、盐类的水解(只有可溶于水的盐才水解) 1、盐类水解:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。 2、水解的实质:水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合,破坏水的电离,是平衡向右移动,促进水的电离。 3、盐类水解规律: ①有弱才水解,无弱不水解,越弱越水解;谁强显谁性,两弱都水解,同强显中性。 ②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。 (如:Na2CO3 >NaHCO3) 4、盐类水解的特点:(1)可逆(与中和反应互逆) (2)程度小 (3)吸热 5、影响盐类水解的外界因素: ①温度:温度越高水解程度越大 (水解吸热,越热越水解) ②浓度:浓度越小,水解程度越大 (越稀越水解) ③酸碱:促进或抑制盐的水解(H+促进阴离子水解而抑制阳离子水解;OH -促进阳离子水解而抑制阴离子水解) 6、酸式盐溶液的酸碱性: ①只电离不水解:如HSO4-显酸性 ②电离程度>水解程度,显酸性 (如: HSO3- 、H2PO4-) ③水解程度>电离程度,显碱性 (如:HCO3- 、HS- 、HPO42-) 7、双水解反应: (1)构成盐的阴阳离子均能发生水解的反应。双水解反应相互促进,水解程度较大,有的甚至水解完全。使得平衡向右移。 (2)常见的双水解反应完全的为:Fe3+、Al3+与AlO2-、CO32-(HCO3-)、S2-(HS-)、SO32-(HSO3-);S2-与NH4+;CO32-(HCO3-)与NH4+其特点是相互水解成沉淀或气体。双水解完全的离子方程式配平依据是两边电荷平衡,如:2Al3+ + 3S2- + 6H2O == 2Al(OH)3↓+ 3H2S↑ 8、盐类水解的应用: 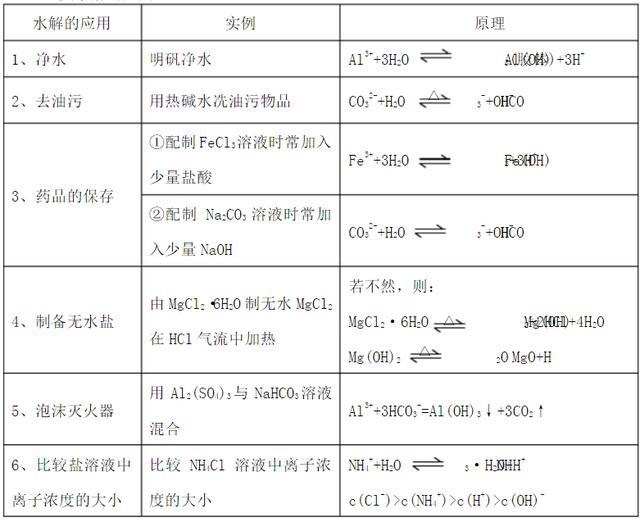 9、水解平衡常数 (Kh) 对于强碱弱酸盐:Kh =Kw/Ka(Kw为该温度下水的离子积,Ka为该条件下该弱酸根形成的弱酸的电离平衡常数)对于强酸弱碱盐:Kh =Kw/Kb(Kw为该温度下水的离子积,Kb为该条件下该弱碱根形成的弱碱的电离平衡常数)电离、水解方程式的书写原则 1、多元弱酸(多元弱酸盐)的电离(水解)的书写原则:分步书写 注意:不管是水解还是电离,都决定于第一步,第二步一般相当微弱。 2、多元弱碱(多元弱碱盐)的电离(水解)书写原则:一步书写 八、溶液中微粒浓度的大小比较 ☆☆基本原则:抓住溶液中微粒浓度必须满足的三种守恒关系: ①电荷守恒::任何溶液均显电中性,各阳离子浓度与其所带电荷数的乘积之和=各阴离子浓度与其所带电荷数的乘积之和 ②物料守恒: (即原子个数守恒或质量守恒) 某原子的总量(或总浓度)=其以各种形式存在的所有微粒的量(或浓度)之和 ③质子守恒:即水电离出的H+浓度与OH-浓度相等。 九、难溶电解质的溶解平衡 1、难溶电解质的溶解平衡的一些常见知识 (1)溶解度小于 0.01g的电解质称难溶电解质。 (2)反应后离子浓度降至1*10-5以下的反应为完全反应。如酸碱中和时[H+]降至10-7mol/L (3)难溶并非不溶,任何难溶物在水中均存在溶解平衡。 (4)掌握三种微溶物质:CaSO4、Ca(OH)2、Ag2SO4 (5)溶解平衡常为吸热,但Ca(OH)2为放热,升温其溶解度减少。 (6)溶解平衡存在的前提是:必须存在沉淀,否则不存在平衡。 2、溶解平衡方程式的书写 3、沉淀生成的三种主要方式 (1)加沉淀剂法:Ksp越小(即沉淀越难溶),沉淀越完全;沉淀剂过量能使沉淀更完全。 (2)调pH值除某些易水解的金属阳离子:如加MgO除去MgCl2溶液中FeCl3。 (3)氧化还原沉淀法: (4)同离子效应法 4、沉淀的溶解: 沉淀的溶解就是使溶解平衡正向移动。常采用的方法有:①酸碱;②氧化还原;③沉淀转化 。 5、沉淀的转化: 溶解度大的生成溶解度小的,溶解度小的生成溶解度更小的。 6、溶度积(KSP) 1、定义:在一定条件下,难溶电解质电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。 2、表达式:AmBn(s) mAn+(aq)+nBm-(aq) KSP= [c(An+)]m [c(Bm-)]n 3、影响因素: 外因:①浓度:加水,平衡向溶解方向移动。 ②温度:升温,多数平衡向溶解方向移动。 4、溶度积规则 QC(离子积)〉KSP有沉淀析出 QC= KSP平衡状态 QC〈KSP饱和,继续溶解 (责任编辑:admin) |