2018高考化学冲刺,弱电解质的电离平衡知识总结
http://www.newdu.com 2025/12/02 10:12:23 三好网 佚名 参加讨论
2018高考化学备考过程中,很多同学感到化学知识点多,记起来很吃力。但是,如果将一些知识点总结起来,形成脉络体系,综合记忆,就会容易很多。小编将2018高考化学冲刺,弱电解质的电离平衡知识总结如下:  1.电离平衡的建立 在一定条件下(如温度、压强等),当弱电解质电离的速率和离子结合成分子的速率相等时,电离过程达到了平衡 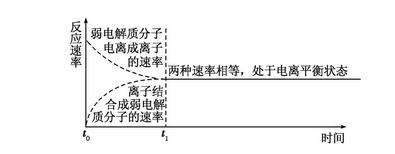 2.电离平衡的特征  3.外界条件对电离平衡的影响 (1)内因 弱电解质本身的性质。 (2)外因 电离过程是可逆过程,可直接用化学平衡移动原理去分析电离平衡。 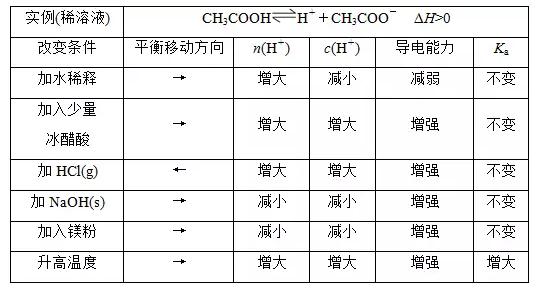 4.强弱电解质的比较与判断 (1)一元强酸和一元弱酸的比较 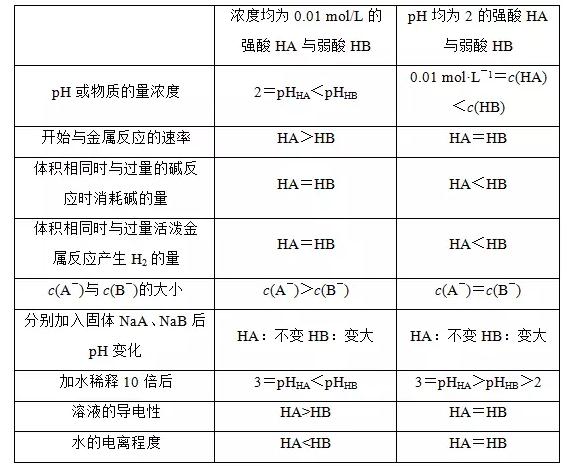 (2)判断弱电解质的三个角度 角度一 弱电解质的定义,即弱电解质不能完全电离,如测得0.1 mol/L的CH3COOH溶液的pH>1。 角度二 弱电解质溶液中存在电离平衡,条件改变,平衡移动,如pH=1的CH3COOH加水稀释10倍1<pH<2。 角度三 弱电解质形成的盐类能水解,如判断CH3COOH为弱酸可用下面两个现象: ①配制某浓度的醋酸钠溶液,向其中加入几滴酚酞溶液。现象:溶液变为浅红色。 ②用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH。现象:pH>7。 文章来源于网络,由编辑整理,如有侵权请及时联系删除。 (责任编辑:admin) |