2018高考有机化学二轮复习甲烷知识点
http://www.newdu.com 2025/12/01 11:12:04 三好网 佚名 参加讨论
2018年高考二轮复习是高考成绩提升的关键期,考生一定要积极备考,梳理高中学科知识脉络,牢记知识点。小编整理了2018高考有机化学二轮复习知识点,最简单的有机化合物——甲烷知识总结如下: 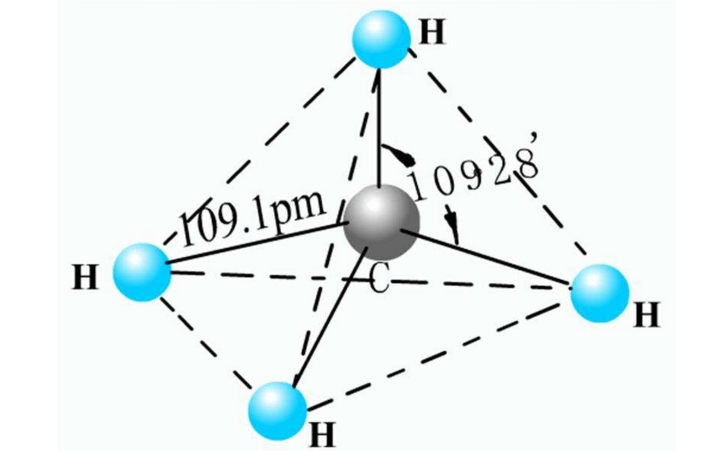 一、甲烷的存在、用途及结构 1.甲烷的存在与用途 (1)甲烷的存在 甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分。我国的天然气主要分布在中西部地区及海底。 (2)甲烷的主要用途 甲烷易燃烧,完全燃烧生成CO2、H2O并放出大量的热量,因此甲烷可用作燃料。天然气和沼气都是理想的清洁能源。甲烷还可用作化工原料。 2.甲烷的组成与结构 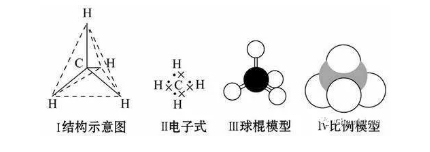 二、甲烷的性质 1.甲烷的物理性质 甲烷是一种无色、无味、极难溶于水、密度比空气小的气体。 2.甲烷的化学性质 (1)甲烷的燃烧反应(氧化反应) 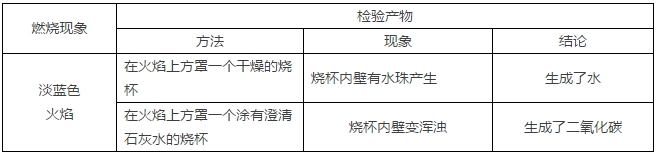 ①甲烷的燃烧 CH4+2O2→CO2+2H2O 甲烷是优良的气体燃料,通常状况下,1 mol甲烷完全燃烧生成二氧化碳和水,放出890 kJ能量。因此以甲烷为主要成分的天然气、沼气是理想的清洁能源。 特别提醒 ①点燃甲烷前必须检验纯度。空气中的甲烷含量在5%~15.4%(体积)范围内时,遇火花发生爆炸;②煤矿中的瓦斯爆炸多数是甲烷气体爆炸引发的。 ②将CH4通入酸性KMnO4溶液中,酸性KMnO4溶液的颜色不发生变化,CH4分子为正四面体结构,结构对称,通常情况下化学性质比较稳定。 (2)甲烷的取代反应 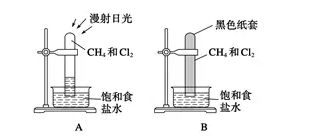 实验现象 A装置:(1)试管内气体颜色逐渐变浅,(2)试管内壁有油状液滴出现,(3)试管中有少量白雾,(4)试管内液面上升,(5)水槽中有固体析出; B装置:无明显现象 实验结论 CH4与Cl2在光照时才能发生化学反应。 ①化学反应方程式 CH4+Cl2→CH3Cl+HCl; CH3Cl+Cl2→CH2Cl2+HCl; CH2Cl2+Cl2→CHCl3+HCl; CHCl3+Cl2→CCl4+HCl。 ②取代反应是指有机物分子中的某些原子或原子团被其他原子或原子团所替代的反应。CH4和Cl2反应的四种取代产物都不溶于水,除一氯甲烷常温下是气体外,其他三种都是油状液体。 ③问题讨论 a.若把甲烷分子中的一个氢原子换成氯原子变成一氯甲烷,还是正四面体结构吗? 答案:因C—H键与C—Cl键的长度不同,故CH3Cl是四面体结构,但不是正四面体结构。 b.CH4与Cl2发生取代反应时,有机取代产物的总物质的量与CH4的物质的量有何关系? 答案:根据碳元素守恒,四种有机取代产物的总物质的量等于反应物CH4的物质的量。 c.CH3Cl、CCl4只有一种结构,能说明CH4分子是以碳原子为中心的正四面体结构而不是正方形的平面结构吗? 答案:不能。因为不论CH4分子是以碳原子为中心的正四面体结构,还是正方形的平面结构,CH3Cl、CCl4均只有一种结构。 三、烷烃 1.烷烃的结构特点 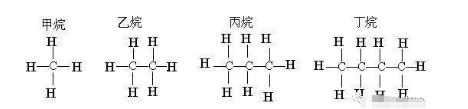 (1)每个碳原子形成4个共价键,且原子之间只以单键相连成链状,碳原子的剩余价键均与氢原子结合。 (2)烃分子中碳原子之间都以碳碳单键结合成链状,剩余价键均与氢原子结合,使每个碳原子的化合价都达到“饱和”,这样的烃叫做饱和链烃,也称烷烃。其分子通式为CnH2n+2(n≥1且n为整数)。烷烃的空间结构中,碳原子(大于等于3时)不在一条直线上,直链烷烃空间构型是折线形或锯齿状。 2.烷烃的物理性质 烷烃的物理性质随着分子中碳原子数的增多,呈规律性的变化。 (1)常温下其状态由气态变到液态又变到固态,熔、沸点逐渐升高,相对密度逐渐增大。 (2)常温下,碳原子数小于或等于4时,均为气态(新戊烷常温下也为气态)。 3.物质的组成、结构决定物质的性质,烷烃的化学性质与甲烷相似。 (1)丙烷的燃烧 CH3CH2CH3+5O2→3CO2+4H2O。 (2)光照条件下,乙烷与氯气发生取代反应(只要求写一氯取代) CH3CH3+Cl2→CH3CH2Cl+HCl。 文章来源于网络,由编辑整理,如有侵权请及时联系删除。 (责任编辑:admin) |