2018高考化学二轮复习卤族元素性质知识专题总结
http://www.newdu.com 2025/12/01 06:12:17 三好网 佚名 参加讨论
2018年高考二轮复习已经开始,相信你有了一轮复习基础知识的积累,在二轮复习能力提升上一定会得心应手。小编整理了2018高考化学二轮复习知识点专题,卤族元素的性质知识总结如下: 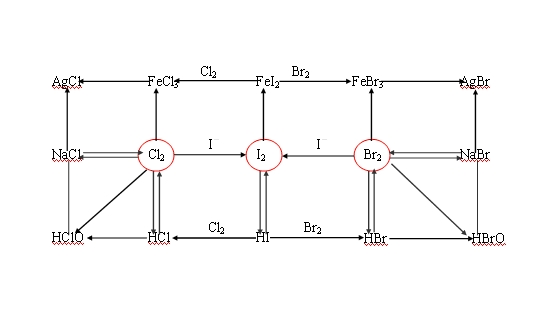 1.卤族元素性质的递变规律 包含元素为:氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At),原子半径逐渐增大,非金属性逐渐减弱。 2.卤素单质物理性质的递变规律 (1)单质颜色逐渐加深 F2:浅黄绿色气体 Cl2:黄绿色气体 Br2:深红棕色液体 I2:紫黑色固体 (2)密度逐渐增大 (3)熔、沸点逐渐升高  利用实验判断Cl2、Br2、I2氧化性强弱的实验方法 (1)卤素单质间的置换 ①将Cl2通入NaBr溶液中发生反应:Cl2+2NaBr===Br2+2NaCl。说明氧化性:Cl2>Br2。 ②将溴水滴入KI_淀粉溶液中,溶液变成蓝色,发生反应:Br2+2KI===I2+2KBr。说明氧化性:Br2>I2。 (2)与氢气化合的难易程度,越易化合,则氧化性越强。 H2与Cl2的混合气体光照爆炸;H2与Br2的混合气体加热才能反应;H2与I2反应很困难。 说明氧化性:Cl2>Br2>I2。 (3)氢化物的稳定性。 利用HCl、HBr、HI的热稳定性来判断元素非金属性的强弱;HCl、HBr、HI的热稳定性越来越差,说明元素的非金属性Cl>Br>I。 4.卤素单质性质的特殊性 (1)Br2是常温下唯一呈液态的非金属单质;液溴易挥发且有毒,通常用水液封来保存。 (2)I2易升华,I2遇淀粉变蓝。 (3)Br2和I2都可被某些有机溶剂(如四氯化碳、苯)萃取。 (4)氟元素无正价,F2与H2O发生置换反应生成O2:2F2+2H2O===4HF+O2。 文章来源于网络,由编辑整理,如有侵权请及时联系删除。 (责任编辑:admin) |