2018高考化学二轮金属单质钠知识点专题总结
http://www.newdu.com 2025/12/02 09:12:27 三好网 佚名 参加讨论
2018年高考二轮复习已经开始,相信你有了一轮复习基础知识的积累,在二轮复习能力提升上一定会得心应手。小编整理了2018高考化学二轮复习知识点专题,活泼的金属单质——钠知识点总结如下: 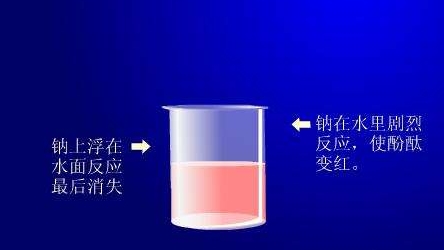 1.钠的原子结构 钠位于元素周期表中第三周期ⅠA族,最外层只有1个电子,在化学反应中易失去最外层电子而呈现+1价,因而钠在化学反应中表现出较强的还原性。  2.钠的性质 (1)物理性质 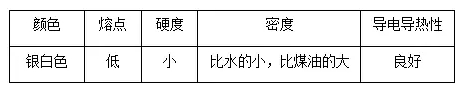 (2)化学性质 ①与非金属单质(如O2、Cl2)的反应 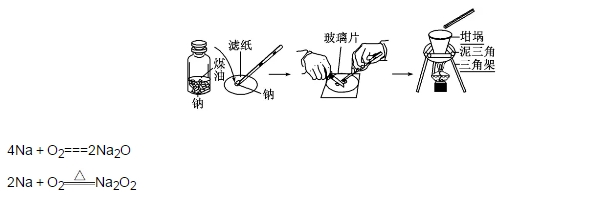 【备注】 钠的取用方法:用镊子夹取一小块钠,用滤纸吸干表面的煤油,用小刀切取黄豆大小的钠,剩余的钠放回原试剂瓶。 钠失火的处理:沙土盖灭,不能用水或泡沫灭火器灭火。 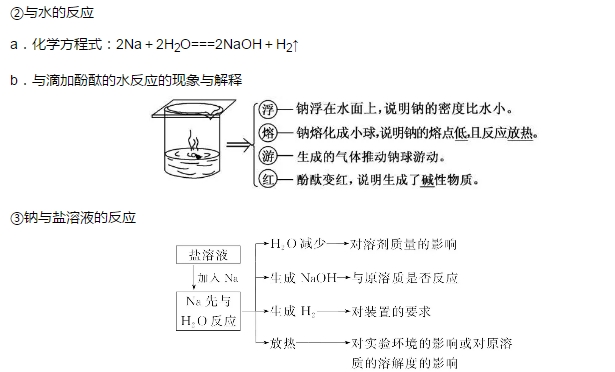   钠的氧化物——氧化钠和过氧化钠 一、钠的氧化物 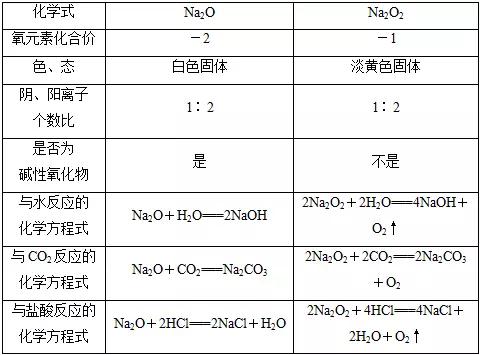 二、过氧化钠的强氧化性 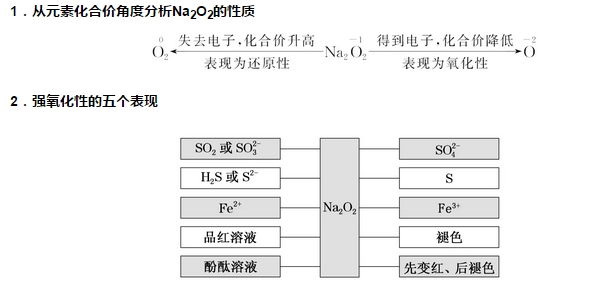 三、Na2O2与水、CO2反应的四个重要关系 1.物质的量的关系 无论是CO2或H2O(g)的单一物质还是二者的混合物,与足量的Na2O2反应时,消耗CO2或H2O(g)与放出O2的物质的量之比均为2∶1,即气体减小的体积等于生成的O2的体积。  结论:凡分子组成符合(CO)m·(H2)n的物质,m g该物质在O2中完全燃烧,将其产物(CO2和水蒸气)通过足量Na2O2后,固体增重必为mg。或者是由C、H、O三种元素组成的物质,只要C、O原子个数比为1∶1,即可满足上述条件。 中学阶段常见的符合这一关系的物质有: (1)无机物:H2、CO及H2和CO的混合气体; (2)有机物:CH3OH(甲醇)、HCHO(甲醛)、CH3COOH(乙酸)、C6H12O6(葡萄糖)等  结论:若CO2和水蒸气的混合气体(或单一气体)通过足量的Na2O2,则气体体积减少的量等于原混合气体体积的,且等于生成氧气的体积。 4.先后顺序关系 一定量Na2O2与一定量CO2和H2O(g)的混合物反应,解决问题时可视作Na2O2先与CO2反应,待CO2反应完成后,Na2O2再与H2O(g)发生反应(实际情况复杂得多)。 5.电子转移关系 不论是与CO2还是与H2O(g)反应,CO2与H2O(g)均既不是氧化剂也不是还原剂,反应的实质都是Na2O2自身发生的氧化还原反应,所以每有1 mol O2生成时,转移的电子均为2 mol。 钠重要的两种盐——碳酸钠与碳酸氢钠 一、碳酸钠与碳酸氢钠 1.物理性质 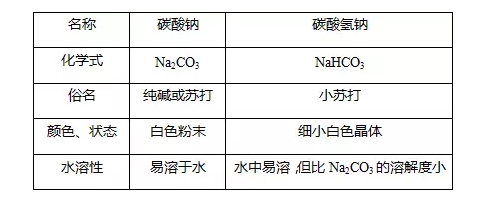 备注:因NaHCO3的溶解度较小,将CO2通入到饱和Na2CO3溶液时,开始无明显现象,后有沉淀析出。  3.主要用途 (1)碳酸钠:用于造纸、制造玻璃、制皂、洗涤等。 (2)碳酸氢钠:用于发酵、医药、灭火剂等。 二、鉴别碳酸钠与碳酸氢钠的方法 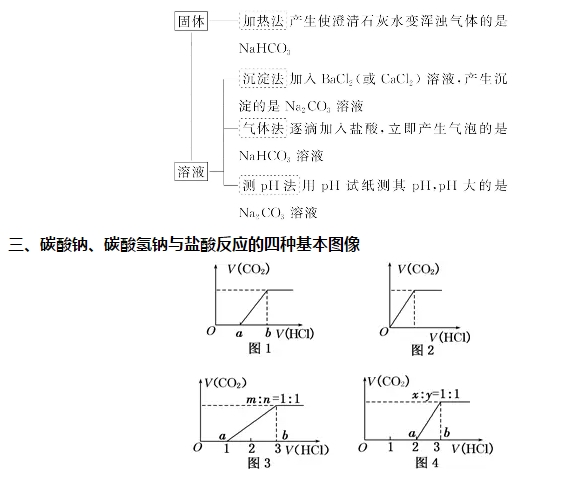  文章来源于网络,由编辑整理,如有侵权请及时联系删除。 (责任编辑:admin) |