高考考前复习,高中化学必修一氮的氧化物知识点
http://www.newdu.com 2025/12/01 05:12:00 三好网 佚名 参加讨论
虽然考前刷历年真题很重要,但是在刷题之前一定要扎实基础。化学知识点又繁多,所以一定要梳理清思路。小编整理了高考考前复习,高中化学必修一氮的氧化物知识点如下。  1.氮的氧化物 氮有多种价态的氧化物,如N2O、NO、NO2、N2O4、N2O3、N2O5等,其中属于酸性氧化物的是N2O3、N2O5。 2.NO与NO2性质的比较  3.氮氧化物与O2、H2O反应的计算方法 (1)电子守恒 当NOx转化为硝酸时要失去电子,如果是NOx与O2混合,则反应中O2得到的电子数与NOx失去的电子数相等。 (2)原子守恒法 4NO2+O2和4NO+3O2从组成上均相当于2N2O5的组成,都与N2O5+H2O===2HNO3等效。当NO、NO2、O2的混合气体溶于水时利用混合气体中N、O原子个数比进行分析判断。 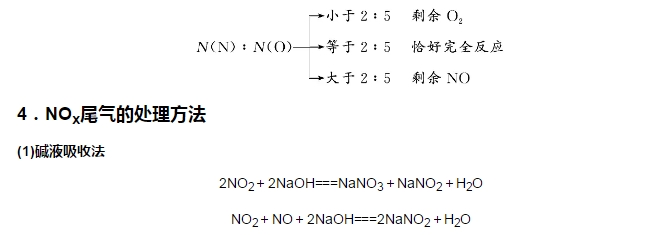 NO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是:n(NO2)≥n(NO)。一般适合工业尾气中NOx的处理。 (2)催化转化法 在催化剂、加热条件下,氨可将氮氧化物转化为无毒气体(N2)或NOx与CO在一定温度下催化转化为无毒气体(N2和CO2)。一般适用于汽车尾气的处理。 5.氮氧化物对环境的影响 (1)光化学烟雾 NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生的一种有毒的烟雾。 (2)酸雨 NOx排入大气中后,与水反应生成HNO3和HNO2,随雨雪降到地面。 反应的化学方程式为2NO+O2===2NO2,3NO2+H2O===2HNO3+NO。 (3)破坏臭氧层 科学研究表明,进入高空平流层的氮氧化物,可以加快臭氧层中臭氧的分解速率,从而像氟氯烃类物质一样破坏臭氧层,形成臭氧空洞:2O33O2。导致地面紫外线辐射量增加。 文章来源于网络,由编辑整理,如有侵权请及时联系删除。 (责任编辑:admin) |