2021年高考化学一轮复习,铁及其化合物考点详解
http://www.newdu.com 2025/11/30 10:11:31 三好网 佚名 参加讨论
为了帮助2021年高考生提高复习效率,高中化学老师给大家带来高考化学一轮复习的知识点详解,下面是有关铁及其化合物考点详解,收藏练习吧!   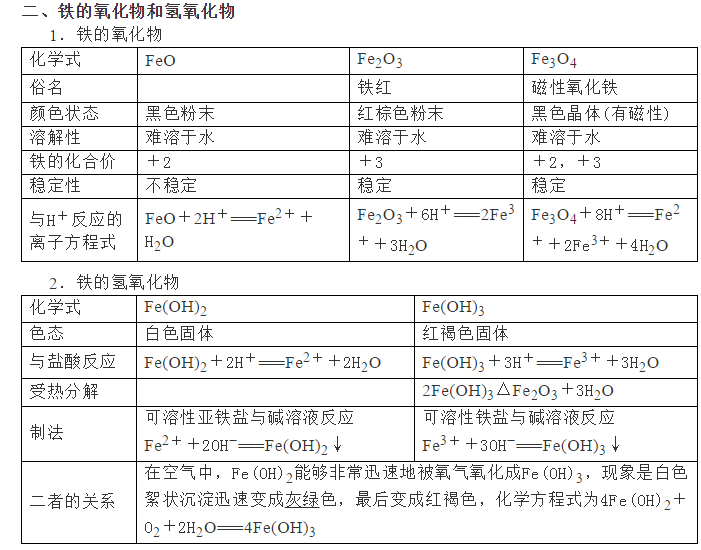   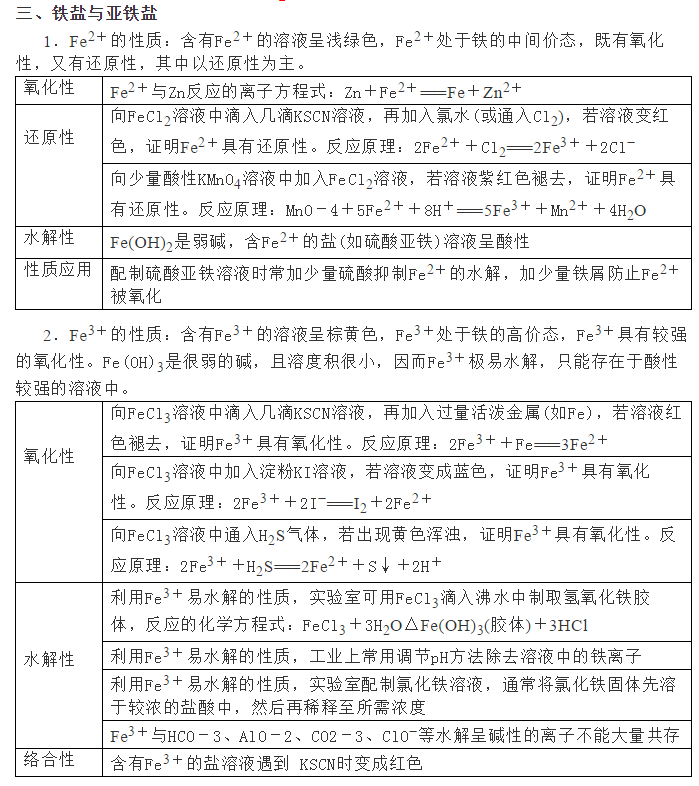  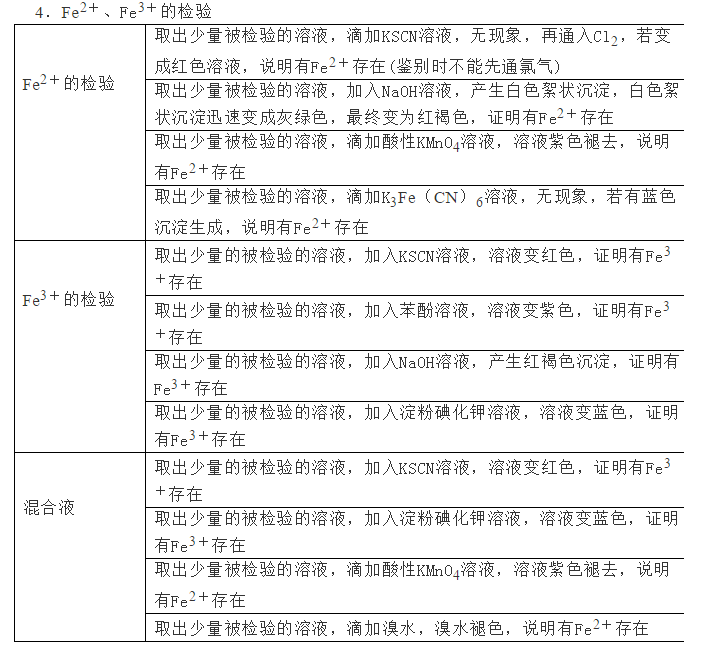 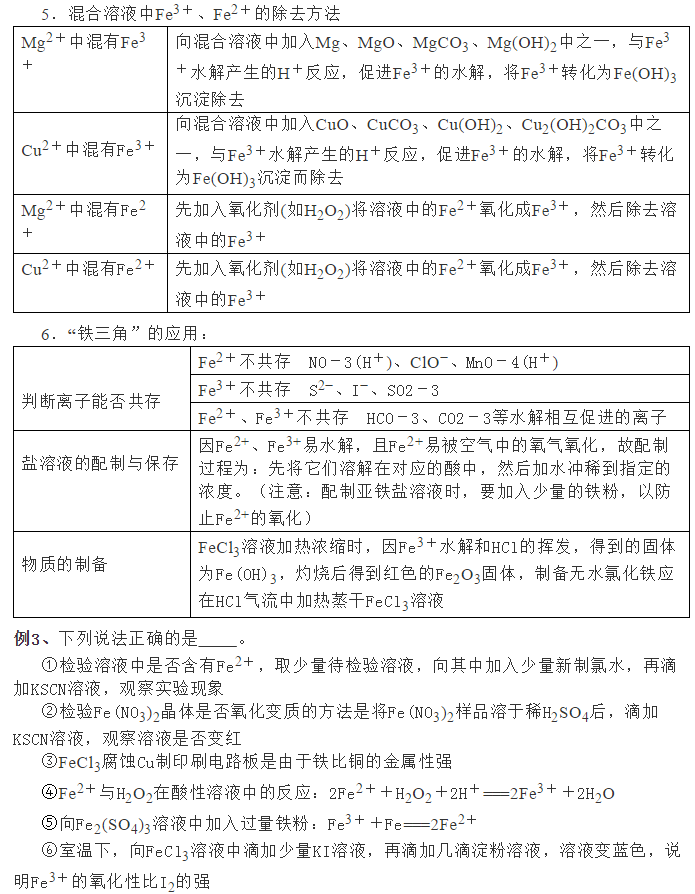  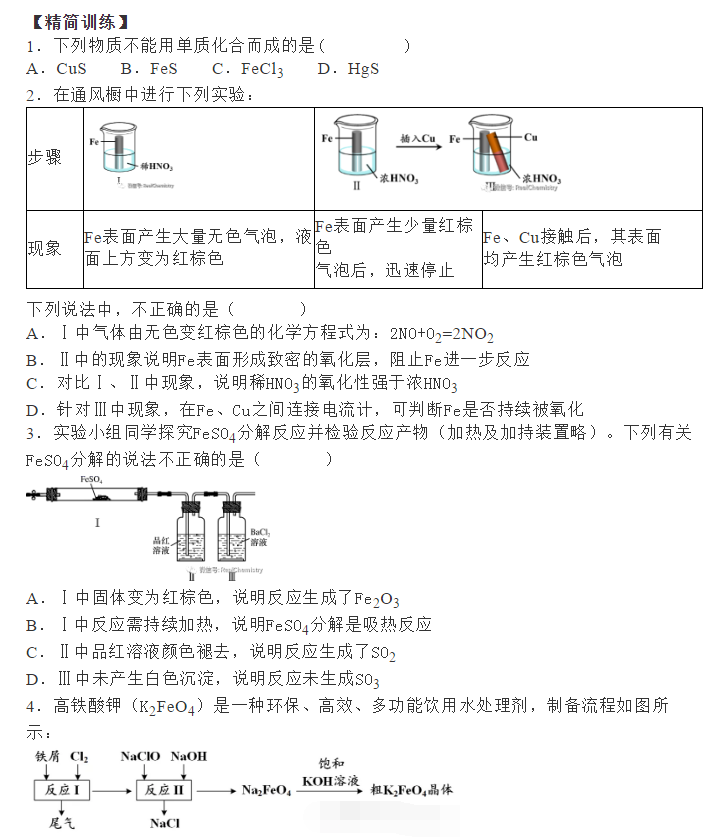 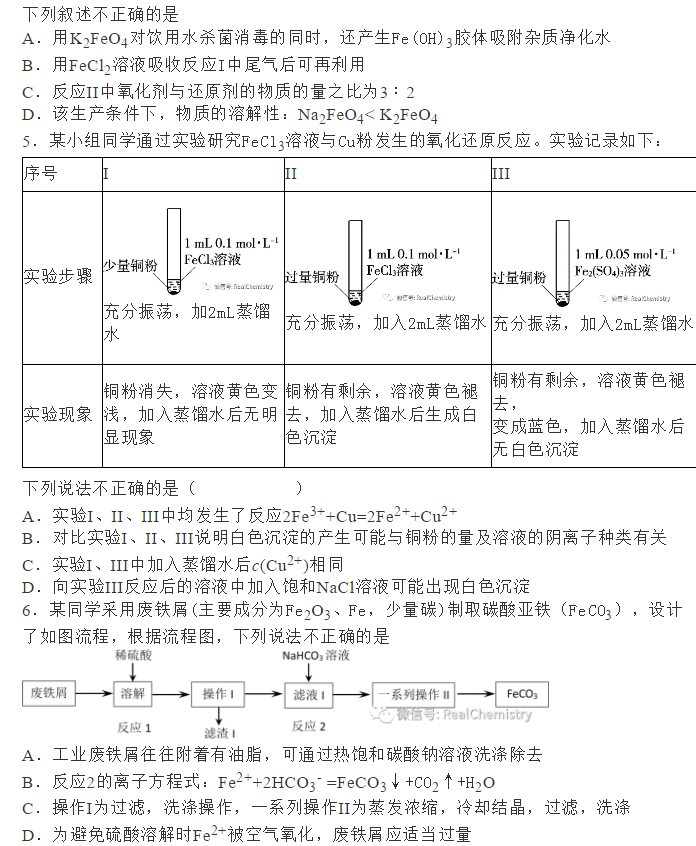 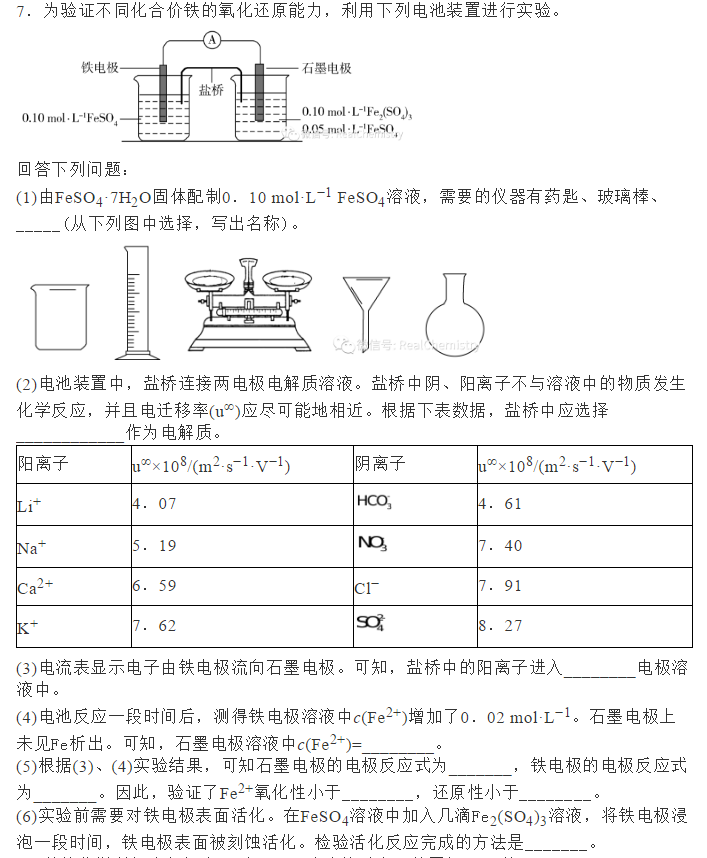   参考答案 1.A【解析】A.S元素氧化性较弱,与Cu反应时只能将铜氧化成较低价态,生成Cu2S,故A符合题意; B.S元素氧化性较弱,与Fe反应时只能将铁氧化成较低价态,生成FeS,故B不符合题意; C.氯气氧化性强,可以将金属氧化成较高价态,与Fe反应生成FeCl3,故C不符合题意; D.Hg单质和S单质反应生成HgS,故D不符合题意; 故答案为A。 2.C【解析】I中铁和稀硝酸生成一氧化氮,一氧化氮遇空气生成二氧化氮;Ⅱ中Fe遇浓硝酸钝化,表面形成致密的氧化层,阻止Fe进一步反应,所以产生少量红棕色气泡后,迅速停止;Ⅲ中构成原电池,Fe作为负极,且Fe与浓硝酸直接接触,会产生少量二氧化氮,Cu作为正极,发生得电子的反应,生成二氧化氮。 A.I中铁和稀硝酸生成一氧化氮,一氧化氮遇空气生成二氧化氮,化学方程式为:2NO+O2=2NO2,A正确; B.常温下,Fe遇浓硝酸易钝化,表面形成致密的氧化层,阻止Fe进一步反应,B正确; C.对比Ⅰ、Ⅱ中现象,说明浓HNO3的氧化性强于稀HNO3,C错误; D.Ⅲ中构成原电池,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化,D正确; 答案选C。 3.D【解析】A.Ⅰ中固体变为红棕色,说明FeSO4分解生成了红棕色的Fe2O3,故A正确; B.Ⅰ中反应需持续加热,说明FeSO4分解反应本身不放热,需要不断提供热量,说明FeSO4分解是吸热反应,故B正确; C.SO2具有漂白性,能使品红溶液褪色,则Ⅱ中品红溶液颜色褪去,说明FeSO4分解生成了SO2,故C正确; D.SO3是酸性氧化物,易与水反应生成硫酸,混合气体通过品红溶液使SO3被完全吸收,没有SO3进入氯化钡溶液中,则Ⅲ中未产生白色沉淀,不能说明反应未生成SO3,故D错误; 故选D。 4.D【解析】铁与氯气反应生成氯化铁,加入NaClO、NaOH,次氯酸钠将铁离子在碱性条件下氧化成Na2FeO4,加入饱和KOH溶液可析出高铁酸钾(K2FeO4),分离得到粗K2FeO4,采用重结晶、洗涤、低温烘干将其提纯,以此解答该题。 A.K2FeO4具有强氧化性,可用于杀菌消毒,生成的铁离子可水解生成具有吸附性的氢氧化铁胶体,可用于净水,故A正确; B.尾气含有氯气,可与氯化亚铁反应生成氯化铁,可再利用,故B正确; C.反应中Cl元素化合价由+1价降低为-1价,Fe元素化合价由+3价升高到+6价,则氧化剂与还原剂的物质的量之比为3:2,故C正确; D.结晶过程中加入浓KOH溶液,增大了K+浓度,该温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小,有利于K2FeO4晶体的析出,故D错误; 故选D。 5.C【解析】A.三组实验中溶液中均含有Fe3+,加入了铜粉,均会发生2Fe3++Cu=2Fe2++Cu2+,故A正确; B.对比实验I、Ⅱ可知,白色沉淀的产生与铜粉的量有关,对比实验Ⅱ、III可知,白色沉淀的产生与溶液的阴离子种类有关,故B正确; C.实验I中铜粉少量,且完全消失,所以不能确定是否将Fe3+全部反应,所以实验I、III中加入蒸馏水后c(Cu2+)不一定相同,故C错误; D.根据实验Ⅱ的现象可知,当铜过量且氯离子存在时会产生沉淀,所以向实验Ⅲ反应后的溶液中加入饱和NaCl溶液,可能出现白色沉淀,故D正确; 故答案为C。 6.C【解析】废铁屑(主要成分为Fe2O3、Fe,少量碳)中加入稀硫酸,发生反应Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4、Fe+H2SO4=FeSO4+H2↑,过滤,将少量碳滤出;滤液中加入NaHCO3溶液,发生反应Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;过滤后,洗涤、干燥,即得FeCO3。 A.洗涤废铁屑表面的油脂,可使用热的饱和碳酸钠溶液,A正确; B.由以上分析知,反应2的离子方程式:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,B正确; C.因为操作II是从混合物中分离出FeCO3沉淀,所以应为过滤、洗涤、干燥等操作,C不正确; D.Fe2+具有较强的还原性,洗涤时易被空气中的氧气氧化,所以废铁屑应适当过量,D正确; 故选BC。 7.(1)烧杯、量筒、托盘天平(2)KCl(3)石墨(4)0.09mol/L(5)Fe3++e-=Fe2+,Fe-2e-=Fe2+,Fe3+,Fe(6)取活化后溶液少许于试管中,加入KSCN溶液,若溶液不出现血红色,说明活化反应完成 【解析】(1)由FeSO4·7H2O固体配制0.10mol·L-1FeSO4溶液的步骤为计算、称量、溶解并冷却至室温、移液、洗涤、定容、摇匀、装瓶、贴标签,由FeSO4·7H2O固体配制0.10mol·L-1FeSO4溶液需要的仪器有药匙、托盘天平、合适的量筒、烧杯、玻璃棒、合适的容量瓶、胶头滴管,故答案为:烧杯、量筒、托盘天平。    声明: (责任编辑:admin) |