高二化学选择性必修1第一章实验,中和反应热及中和反应热的测定
http://www.newdu.com 2025/12/01 02:12:34 三好网 佚名 参加讨论
反应热是高二化学的第一章第一个知识点,需要同学们掌握中和反应热的概念及定义;掌握测定化学反应热的实验思路,实验步骤等注意事项;正确分析测定中和反应热时产生误差的原因。高中化学老师带来中和反应热及中和反应热的测定的知识要点和实验步骤,帮助大家查缺补漏,复习与提升。  中和反应热: 定义:在稀溶液中,强酸与强碱发生中和反应生成1molH2O(l)时的反应热。 表示:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol 知识要点 1“稀溶液” 浓硫酸,固体氢氧化钠等酸碱反应放出的能量不是中和热 2“强酸,强碱” 涉及弱酸,弱碱的中和反应放出的能量变化不是标准的中和反应热 原因:弱酸,弱碱电离需要能量 3“1mol水” 中和反应生成的水必需是1mol 如:含有1mol硫酸的稀溶液和足量的氢氧化钠稀溶液反应放出的能量为两倍的中和热 而含有1mol氢氧化钠的稀溶液和足量的硫酸稀溶液反应放出的能量为中和热 4离子反应方程式必须是:H++OH-=H2O 如:含有1mol硫酸的稀溶液和足量的的氢氧化钡稀溶液反应放出的能量不仅不是中和反应热,而且不是中和反应热的两倍 中和反应热的测定: 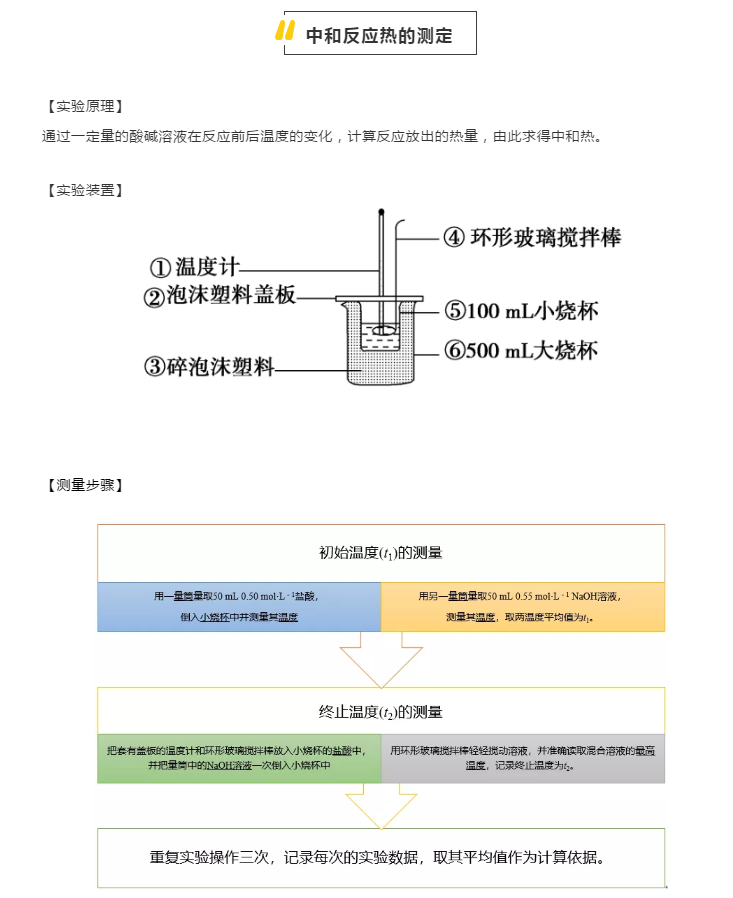  【数据处理】 Q=cmΔt=4.18×100×ΔtJ ΔH=Q×10-3/0.025kJ/mol 【例1】已知:H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3kJ/mol。下列反应中能放出57.3kJ热量的是() A.1L1mol·L-1的稀H2SO4与足量NaOH溶液反应 B.稀盐酸与氨水反应生成1molH2O C.稀盐酸与稀Ba(OH)2溶液反应生成1mol水 D.稀NaOH溶液与95%浓硫酸反应生成1mol水 【解析】A项,生成2molH2O(l),放出114.6kJ热量;B项,氨水为弱碱溶液,NH3·H2O电离吸热,故放出热量小于57.3kJ;D项,浓H2SO4溶于水放热,故放出的热量大于57.3kJ。 【答案】C 【例2】强酸和强碱在稀溶液中反应的热化学方程式可表示为 H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol 已知: CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)ΔH=-Q1kJ/mol HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l)ΔH=-Q2kJ/mol CH3COOH(aq)+NH3·H2O(aq)=CH3COONH4(aq)+H2O(l)ΔH=-Q3kJ/mol 上述均是在溶液中进行的反应,Q1、Q2、Q3的关系正确的是() A.Q1=Q2=Q3=57.3 B.Q1>Q2>Q3>57.3 C.Q3<Q1<Q2=57.3 D.无法确定 【解析】因为醋酸、一水合氨为弱电解质,随着中和反应的进行,醋酸、一水合氨发生电离。电离过程为吸热过程,故弱酸、弱碱反应放出的热量小于弱酸、强碱反应放出的热量小于强酸、强碱反应放出的热量。 【答案】C 【例3】下列有关中和反应反应热的说法正确的是() A.中和反应反应热的热化学方程式:H+(l)+OH-(l)=H2O(l)ΔH=-57.3kJ/mol B.准确测量中和反应反应热的实验过程中,至少需测定温度4次 C.环形玻璃搅拌棒材料若用铜代替,则测量出的中和反应反应热数值偏小 D.若稀酸溶液中H+与稀碱溶液中OH-的物质的量相等,则所测中和反应反应热数值更准确 【解析】A项,应为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol;B项,至少测定温度3次,盐酸、NaOH溶液、混合液的温度;D项,为保证反应充分,H+或OH-一方过量。 【答案】C 【例4】实验室进行中和反应反应热的测定实验时除需要大烧杯(500mL)、小烧杯(100mL)外,所用的其他仪器和试剂均正确的一组是() A.0.50mol·L-1盐酸,0.50mol·L-1NaOH溶液,100mL量筒1个 B.0.50mol·L-1盐酸,0.55mol·L-1氨水,100mL量筒2个 C.0.50mol·L-1醋酸,0.55mol·L-1NaOH溶液,50mL量筒1个 D.0.50mol·L-1盐酸,0.55mol·L-1NaOH溶液,50mL量筒2个 【解析】本实验中为了保证0.50mol/L的盐酸完全被中和,采用0.55mol/LNaOH溶液,使碱稍过量,故A项不符合;所需酸、碱量均为50mL且碱为弱碱,故B项不符合;酸、碱分别用不同的量筒量取,且酸为弱酸,故C项不符合。 【答案】D 声明: (责任编辑:admin) |