高二化学选择性必修1第一章第一节反应热
http://www.newdu.com 2025/10/17 12:10:18 三好网 佚名 参加讨论
反应热是高二化学的第一章第一个知识点,需要同学们掌握中和反应热的概念及定义。高中化学老师带来反应热的知识点梳理,帮助大家查缺补漏,复习与提升。  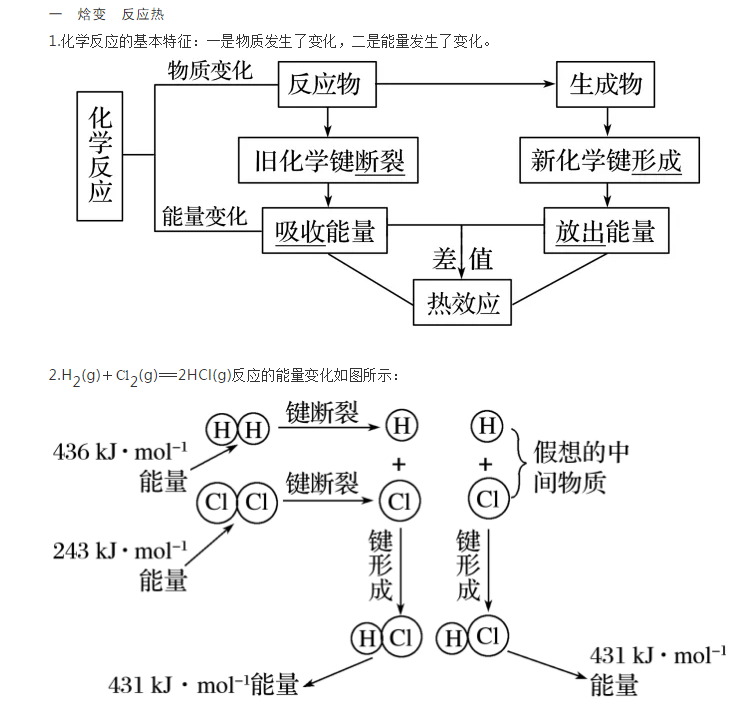 由图可知,1molH2分子中的化学键断裂吸收的能量是436kJ,1molCl2分子中的化学键断裂吸收的能量是243kJ,2molHCl分子中的化学键形成释放的能量是862kJ,则H2(g)+Cl2(g)===2HCl(g)的反应放出的热量为183kJ。 3.反应热、焓变的概念 (1)反应热是化学反应在一定条件下所释放或吸收的热量,符号是ΔH,单位是kJ·mol-1或kJ/mol。 (2)焓(H)是与内能有关的物理量,焓变(ΔH)是生成物与反应物的焓值差。 4.ΔH的正、负和吸热、放热反应的关系 (1)放热反应是反应完成时,生成物释放的总能量大于反应物吸收的总能量的反应。由于反应后放出热量(释放给环境)而使反应体系的能量降低,故ΔH<(填“<”或“>”)0,即ΔH为-(填“+”或“-”)。 常见的放热反应①所有的中和反应②所有的燃烧反应③大多数的化合反应 ④活泼金属与水、较活泼金属与酸的反应⑤铝热反应⑥物质的缓慢氧化等 (2)吸热反应是反应完成时,生成物释放的总能量小于反应物吸收的总能量的反应。由于反应时吸收环境能量而使反应体系的能量升高,故ΔH>(填“<”或“>”)0,即ΔH为+(填“+”或“-”)。 常见的吸热反应①盐的水解和弱电解质的电离②大多数的分解反应 ③Ba(OH)2·8H2O与NH4Cl的反应④碳和水蒸气、C和CO2的反应、氢气还原三氧化钨等 5.有下列反应:①氧化钙与水反应②碳酸氢钠受热分解③硫酸与氢氧化钠溶液混合④燃烧煤炭取暖⑤钠与水反应⑥胆矾受热失去结晶水,其中为吸热反应的是②⑥,放热反应的是①③④⑤。   (1)1molH2在2molCl2中燃烧,放出的热量为kJ。 (2)在一定条件下,1molH2分别与足量的Cl2、Br2、I2反应,放出热量由多到少的顺序是(填字母)。 A.Cl2>Br2>I2B.I2>Br2>Cl2 答案(1)179(2)A 解析本题涉及键能与吸、放热的关系,考查了键能与反应热的定量关系。(1)1molH2在2molCl2中燃烧,参加反应的H2和Cl2都是1mol,生成2molHCl,则放出热量:436kJ·mol-1×1mol+247kJ·mol-1×1mol-431kJ·mol-1×2mol=-179kJ。(2)反应H2+X2===2HX中,若1molH2和1molX2反应生成2molHX,就有1molH—H键和1molX—X键断裂,2molH—X键形成。放出的热量Q(HX)=E(H—H)+E(X—X)-2·E(H—X)。将表中数据代入可算得:Q(HCl)<Q(HBr)<Q(HI),故H2在Cl2中燃烧放热最多,在I2中放热最少,选A。 二,热化学方程式 1.氢气与碘蒸气化合反应的能量(或热量)变化,可用下式表示:H2(g)+I2(g)200℃2HI(g)ΔH=-14.9kJ·mol-1,它与化学方程式H2+I2△2HI相比较而言,其特点为 (1)指明了反应时的温度和压强:若在25℃、101kPa时进行的反应,可以不注明。 (2)用括号注明了各物质反应时的状态:s(固体)、l(液体)、g(气体)、aq(溶液)。 (3)在方程式的右边注明了ΔH的数值、正负号及单位。 2.热化学方程式的概念及意义 (1)热化学方程式是表示参加反应物质的量和反应热的关系的化学方程式。 (2)热化学方程式的意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化,还说明了物质的“量”与“能量”之间的数量关系。 例如: H2(g)+21O2(g)===H2O(l)ΔH=-285.8kJ·mol-1表示的意义是在25℃、101kPa下,1mol气态H2与21mol气态O2反应生成1mol液态水时,放出的热量是285.8kJ。 3.热化学方程式的书写方法要求 (1)遵循一般化学方程式的书写规则(一般不写反应条件)。 (2)在方程式右端注明热量的变化:吸热反应,ΔH>0;放热反应,ΔH<0。 (3)要注明反应物和生成物的聚集状态。 (4)化学计量数只表示物质的量,因此可以是整数,也可以是分数。 (5)化学计量数改变,ΔH要相应改变;逆反应的ΔH数值与正反应的相等、符号相反。  归纳总结 热化学方程式与普通化学方程式的区别   声明: (责任编辑:admin) |