高一化学必修第一册2019版,第一章氧化还原反应知识点总结
http://www.newdu.com 2025/11/30 06:11:29 三好网 佚名 参加讨论
今天高中化学老师给高一化学必修第一册2019版,第一章离子反应知识点总结,第一章离子反应知识点总结,希望能更好地帮助大家梳理体系。   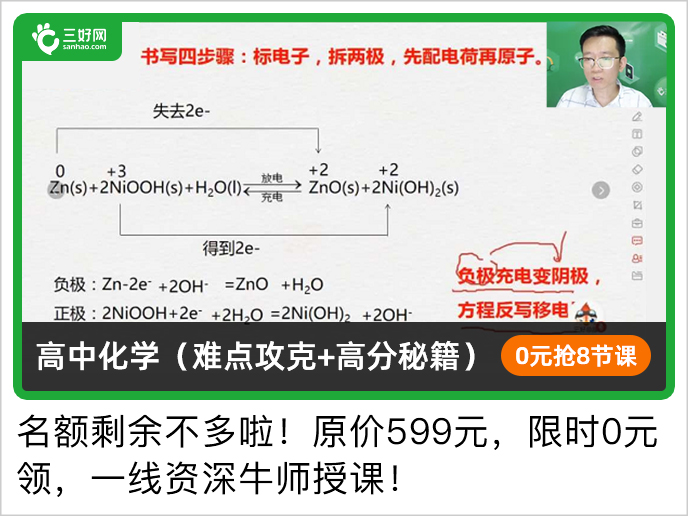 二、氧化还原反应的有关规律 1.守恒律 化合价升高总数与降低总数相等,实质是反应中失电子总数与得电子总数相等.该规律可应用于氧化还原反应方程式的配平及相关计算等. 2.强弱律 氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物. 强弱律的应用:在适宜条件下,用氧化性(还原性)较强的物质可制备氧化性(还原性)较弱的物质;用于比较物质的氧化性或还原性的强弱. 3.优先律 当存在多种还原剂(氧化剂)时,氧化剂(还原剂)通常先和还原性(氧化性)最强的还原剂(氧化剂)反应.如向NaBr和NaI的混合溶液中通入Cl2,因I-的还原性强于Br-,则先发生反应:2I-+Cl2===2Cl-+I2,然后发生反应:2Br-+Cl2===2Cl-+Br2. 4.价态律 有多种价态的元素,处于最高价态时只具有氧化性(如H2SO4中的S元素),处于最低价态时只具有还原性(如H2S中的S元素),处于中间价态时既有氧化性又有还原性(如SO2中的S元素).价态律可应用于判断物质的氧化性、还原性. 5.转化律 同种元素不同价态间发生归中反应时,元素的化合价只接近而不交叉,最多达到同种价态. 如:H2S+H2SO4(浓)===S↓+SO2↑+2H2O(H2→,H2O4→O2)、5Cl-+ClO+6H+===3Cl2↑+3H2O. 解答氧化还原反应有关概念题的“三个步骤” 第一步:依据题意分析概念:“升失氧,降得还;剂性一致,其他相反.”“剂性一致”即氧化剂具有氧化性,还原剂具有还原性.“其他相反”即氧化剂被还原,发生还原反应,生成还原产物;还原剂被氧化,发生氧化反应,生成氧化产物. 第二步:依据规律判断反应的合理性:氧化还原反应遵循化合价互不交叉规律、强弱规律等.同学们应掌握化合价与氧化性的关系,“高价氧化低价还,中间价态两俱全”. 第三步:利用电子守恒进行定量判断:有关氧化还原反应的定量问题,利用得失电子守恒法可以简化计算过程.对于生疏的或多步氧化还原反应,可直接找出起始的氧化剂、还原剂和最终的还原产物、氧化产物,利用原子守恒和电子守恒,建立已知量与未知量的关系,快速列等式求解.  三、氧化还原反应方程式的配平 1.配平依据:氧化还原反应中,元素化合价升高的总数等于元素化合价降低的总数. 2.配平方法 (1)一般氧化还原反应方程式的配平——化合价升降法  解答有关缺项配平类题目的方法和步骤 (1)先根据化合价升降相等的原则配平含变价元素物质前的化学计量数. (2)再根据质量守恒和元素的原子或离子个数守恒配平其他物质. (3)最后通过观察比较反应物、生成物增减原子或离子以确定未知物并配平. 有离子参与的氧化还原反应方程式的配平顺序 (1)根据化合价升降,配平氧化剂、还原剂、氧化产物、还原产物的化学计量数. (2)根据电荷守恒调节离子的化学计量数. (3)最后检查原子守恒和电荷守恒. 声明: (责任编辑:admin) |