高一化学必修一第二章物质的分类,知识点梳理
http://www.newdu.com 2025/11/03 06:11:10 三好网 佚名 参加讨论
对于高一学生来说,化学是一个全新的开始,如果你学的好,就是成绩的有效补充。如果学的不好,也有可能把你的成绩拉下去,成为一个更大的绊脚石!今天小编给新高一的同学们整理了高一化学必修一第二章化学物质的分类知识梳理,接好吧!  第1节物质的分类 一.常见的分类法 1.交叉分类法:根据不同的分类标准,对同一事物进行多种分类的一种分类方法。 特点:可以从多角度对物质进行分类,弥补树状分类法的不足,但条理性不够。 2.树状分类法:对同类事物按照某种属性进行再分类的分类方法。 特点:表示有条理逻辑清晰,但所依据的分类标准有一定的局限性,对物质的分类单一不全面。  [反思归纳] 正确理解“一定”、“不一定”,规避概念失分点 (1)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为两性氧化物、Na2O2为过氧化物)。 (2)酸性氧化物不一定是非金属氧化物(如Mn2O7);非金属氧化物也不一定是酸性氧化物(如CO、NO)。 (3)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、Fe2O3) (4)酸性氧化物都是对应酸的酸酐,但酸酐不一定都是酸性氧化物,如乙酸酐[(CH3CO)2O]。 (5)酸(或碱)的水溶液一定呈酸(或碱)性,但呈酸(或碱)性的溶液不一定是酸(或碱)。 (6)一个一元酸分子一定能电离出一个H+,电离出一个H+的不一定是一元酸(如NaHSO4) (7)盐中一定有酸根离子,有酸根离子的不一定为盐(如H2SO4)。 二.分散系及其分类 1.概念:把一种或多种物质分散在另一种或多种物质中所得到的体系,叫做分散系。 前者属于被分散的物质称作分散质,后者起容纳分散质的作用,称作分散剂。 2.分类 ⑴按照分散质和分散剂的状态分类 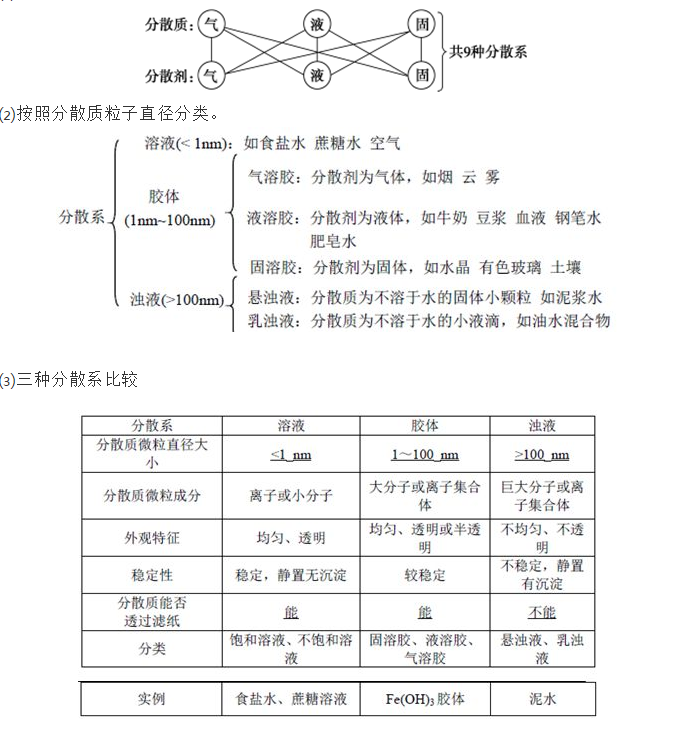 三.胶体的制备和性质 1.Fe(OH)3胶体的制备:在小烧杯中加入蒸馏水,将其加热至沸腾,向沸水中逐滴加入5-6滴FeCl3饱和溶液,继续煮沸至呈现透明的红褐色,停止加热,得到的分散系就是Fe(OH)3胶体。 化学方程式为:FeCl3+3H2O△Fe(OH)3(胶体)+3HCl。 2.胶体的性质 ⑴丁达尔效应 ①概念:当光束通过胶体时,可以看到一条光亮的“通路”的现象。 ②原因:胶体粒子对光线散射所形成的。 ③应用:丁达尔效应可用来鉴别胶体和溶液。 注意:①丁达尔效应是物理变化而不是化学变化。 ②液溶胶和气溶胶能发生丁达尔效应,而固溶胶不能。 ⑵电泳现象 定义:在电场的作用下,胶体粒子在分散剂里向带相反电荷的电极作定向移动的现象叫做电泳。 原因:金属氧化学、金属氢氧化物等胶粒吸附阳离子带正电向阴极移动;非金属氧化物、金属硫化物、硅酸、血液土壤等胶粒吸附阴离子带负电向阳极移动。 注意:①绝大多数胶粒带电,但淀粉胶粒不带电呈电中性。 ②胶粒可能带电,但胶体都是电中性的。 ③固溶胶不具有电泳现象,但液溶胶、气溶胶大都能发生电泳。 ⑶布朗运动 ①定义:胶体粒子不停地做无规则的运动。 ②原因:分散剂分子从各个方向撞击胶体粒子,而每一瞬间胶体粒子在不同方向受的力不同,故胶体粒子运动的方向每一瞬间都在改变。 ⑷介稳性 ①定义:胶体的稳定性介于溶液和浊液之间,在一定条件下能稳定存在,属于介稳体系。 ②胶体分散系稳定的原因:a.同种胶粒带同种电荷互相排斥而不易聚集。 b.布朗运动能克服重力作用,使胶粒不易沉积。 ⑸胶体的聚沉 ①定义:使胶体形成沉淀析出的过程称为聚沉。 ②方法:加入电解质——中和胶粒所带电荷,使之聚集成大颗粒而沉淀。 加热或搅拌胶体——加速胶粒运动,使之易于结合成大颗粒而沉淀。 加入与胶粒带相反电荷的胶体——互相中和电荷,使之聚集而沉淀。  四.胶体的应用 1.利用电泳工业除尘 2.胶体的提纯——渗析 可用渗析法提纯胶体,由于胶体粒子较大不能透过半透膜,而离子、分子较小可以透过半透膜,用此法可以将胶体粒子和溶液中的离子、分子分开。 3.胶体净水 胶体粒子的直径一般在1~100nm之间,它决定了胶体粒子具有较大的表面积,吸附力很强,能在水中吸附悬浮固体或毒素形成沉淀,从而达到净化水的目的,这就是胶体净水的原理。能在水中自然形成胶体,并且对水质无明显副作用的物质有KAl(SO4)2·12H2O、FeCl3·6H2O等,这样的物质被称为净水剂,其形成胶体的化学原理是Al3+、Fe3+发生水解反应生成Al(OH)3、Fe(OH)3胶体。 4.卤水点豆腐 (责任编辑:admin) |