高一化学必修一第三章几种重要的金属化合物
http://www.newdu.com 2025/11/30 09:11:00 三好网 佚名 参加讨论
对于高一学生来说,化学是一个全新的开始,如果你学的好,就是成绩的有效补充。如果学的不好,也有可能把你的成绩拉下去,成为一个更大的绊脚石!今天小编给新高一的同学们整理了高一化学必修一第三章几种重要的金属化合物知识梳理,接好吧!  一、氧化物 1、Al2O3的性质:氧化铝是一种白色难溶物,其熔点很高,可用来制造耐火材料如坩锅、耐火管、耐高温的实验仪器等。 Al2O3是两性氧化物:既能与强酸反应,又能与强碱反应: Al2O3+6HCl=2AlCl3+3H2O(Al2O3+6H+=2Al3++3H2O) Al2O3+2NaOH==2NaAlO2+H2O(Al2O3+2OH-=2AlO2-+H2O) 2、铁的氧化物的性质:FeO、Fe2O3都为碱性氧化物,能与强酸反应生成盐和水。 FeO+2HCl=FeCl2+H2O Fe2O3+6HCl=2FeCl3+3H2O 二、氢氧化物 1、氢氧化铝Al(OH)3 ①Al(OH)3是两性氢氧化物,在常温下它既能与强酸,又能与强碱反应: Al(OH)3+3HCl=AlCl3+3H2O(Al(OH)3+3H+=Al3++3H2O) Al(OH)3+NaOH=NaAlO2+2H2O(Al(OH)3+OH-=AlO2-+2H2O) ②Al(OH)3受热易分解成Al2O3:2Al(OH)3==Al2O3+3H2O(规律:不溶性碱受热均会分解) ③Al(OH)3的制备:实验室用可溶性铝盐和氨水反应来制备Al(OH)3 Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4 (Al3++3NH3·H2O=Al(OH)3↓+3NH4+) 因为强碱(如NaOH)易与Al(OH)3反应,所以实验室不用强碱制备Al(OH)3,而用氨水。 2、铁的氢氧化物:氢氧化亚铁Fe(OH)2(白色)和氢氧化铁Fe(OH)3(红褐色) ①都能与酸反应生成盐和水: Fe(OH)2+2HCl=FeCl2+2H2O(Fe(OH)2+2H+=Fe2++2H2O) Fe(OH)3+3HCl=FeCl3+3H2O(Fe(OH)3+3H+=Fe3++3H2O) ②Fe(OH)2可以被空气中的氧气氧化成Fe(OH)3 4Fe(OH)2+O2+2H2O=4Fe(OH)3(现象:白色沉淀→灰绿色→红褐色) ③Fe(OH)3受热易分解生成Fe2O3:2Fe(OH)3==Fe2O3+3H2O 3、氢氧化钠NaOH:俗称烧碱、火碱、苛性钠,易潮解,有强腐蚀性,具有碱的通性。 三、盐 1、铁盐(铁为+3价)、亚铁盐(铁为+2价)的性质: ①铁盐(铁为+3价)具有氧化性,可以被还原剂(如铁、铜等)还原成亚铁盐: 2FeCl3+Fe=3FeCl2(2Fe3++Fe=3Fe2+)(价态归中规律) 2FeCl3+Cu=2FeCl2+CuCl2(2Fe3++Cu=2Fe2++Cu2+)(制印刷电路板的反应原理) 亚铁盐(铁为+2价)具有还原性,能被氧化剂(如氯气、氧气、硝酸等)氧化成铁盐: 2FeCl2+Cl2=2FeCl3(2Fe2++Cl2=2Fe3++2Cl-) ②Fe3+离子的检验: a.溶液呈黄色; b.加入KSCN(硫氰化钾)溶液变红色; c.加入NaOH溶液反应生成红褐色沉淀[Fe(OH)3]。 Fe2+离子的检验: a.溶液呈浅绿色; b.先在溶液中加入KSCN溶液,不变色,再加入氯水,溶液变红色; c.加入NaOH溶液反应先生成白色沉淀,迅速变成灰绿色沉淀,最后变成红褐色沉淀。 2、钠盐:Na2CO3与NaHCO3的性质比较  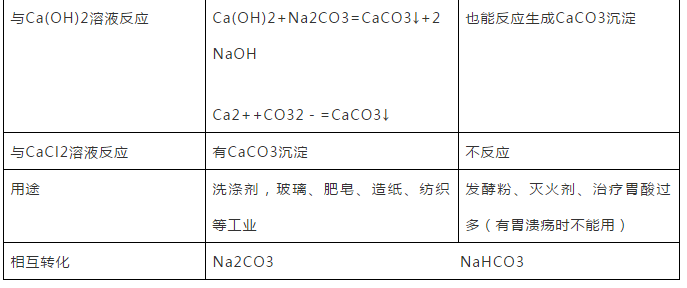 四、焰色反应 1、定义:金属或它们的化合物在灼烧时使火焰呈现特殊颜色的性质。 2、操作步骤:铂丝(或铁丝)用盐酸浸洗后灼烧至无色,沾取试样(单质、化合物、气、液、固均可)在火焰上灼烧,观察颜色。 3、重要元素的焰色:钠元素黄色、钾元素紫色(透过蓝色的钴玻璃观察,以排除钠的焰色的干扰) 焰色反应属物理变化。与元素存在状态(单质、化合物)、物质的聚集状态(气、液、固)等无关,只有少数金属元素有焰色反应。 (责任编辑:admin) |