高二化学下册期末复习,选修4水溶液中的离子平衡知识点
http://www.newdu.com 2025/11/30 10:11:32 三好网 佚名 参加讨论
水溶液中离子平衡怎么才能学好,小编今天就给大家汇总有关高中化学水溶液中的离子平衡的必考知识点,掌握这些,轻松备战期末考试,赶紧来看看吧!  一、电解质和非电解质 (一)概念 (1)电解质:在水溶液里或熔融状态下能导电的化合物 非电解质:在水溶液里和熔融状态下都不能导电的化合物 ①电解质和非电解质均指化合物,单质和混合物既不属于电解质也不属于非电解质。 ②电解质必须是自身能直接电离出自由移动的离子的化合物。 ③对于电解质来说,只须满足一个条件即可,而对非电解质则必须同时满足两个条件。 例如:H2SO4、NaHCO3、NH4Cl、Na2O、Na2O2、Al2O3 (2)强电解质:溶于水或熔融状态下几乎完全电离的电解质 弱电解质:溶于水或熔融状态下只有部分电离的电解质 ①电解质的强弱与化学键有关,但不由化学键类型决定。强电解质含有离子键或强极性键,但含有强极性键的不一定都是强电解质,如H2O、HF等都是弱电解质。 ②电解质的强弱与溶解度无关。如BaSO4、CaCO3等 ③电解质的强弱与溶液的导电能力没有必然联系。 (二)判断 (1)物质类别判断: 强电解质:强酸、强碱、多数盐、部分金属氧化物 弱电解质:弱酸、弱碱、少数盐和水非电解质:非金属氧化物、氢化物(酸除外)、多数有机物单质和混合物(不是电解质也不是非电解质) (2)性质判断: 熔融导电:强电解质(离子化合物)均不导电:非电解质(必须是化合物) (3)实验判断: ①测一定浓度溶液pH②测对应盐溶液pH ③一定pH溶液稀释测pH变化 ④同等条件下测导电性 3 电解质溶液的导电性和导电能力 ①电解质不一定导电(如NaCl晶体、无水醋酸),导电物质不一定是电解质(如石墨),非电解质不导电,但不导电的物质不一定是非电解质。 ②强电解质溶液导电性不一定比弱电解质强。饱和强电解质溶液导电性不一定比弱电解质强。 二、弱电解质的电离平衡 (一)定义和特征 1、电离平衡的含义: 在一定条件(如温度、浓度)下,弱电解质分子电离成离子的速率与离子结合成分子的速率相等,溶液中各分子和离子的浓度都保持不变的状态叫电离平衡状态。 任何弱电解质在水溶液中都存在电离平衡,达到平衡时,弱电解质具有该条件下的最大电离程度。 2、电离平衡的特征 ①逆:弱电解质的电离过程是可逆的,存在电离平衡。 ②等:弱电解质电离成离子的速率和离子结合成分子的速率相等。 ③动:弱电解质电离成离子和离子结合成分子的速率相等,不等于零,是动态平衡。 ④定:弱电解质在溶液中达到电离平衡时,溶液里离子的浓度、分子的浓度都不再改变。 ⑤变:外界条件改变时,平衡被破坏,电离平衡发生移动。 (二)影响电离平衡的因素 ①浓度:越稀越电离在醋酸的电离平衡CH3COOH==CH3COO-+H+加水稀释,平衡向右移动,电离程度变大,但c(CH3COOH)、c(H+)、c(CH3COO-)变小加入少量冰醋酸,平衡向右移动,c(CH3COOH)、c(H+)、c(CH3COO-)增大,但电离程度变小 ②温度:T越高,电离程度越大 ③同离子效应:加入与弱电解质具有相同离子的电解质时,使电离平衡向逆反应方向移动。 ④加入能与弱电解质电离出的离子反应的物质时,可使平衡向电离方向移动。 各种因素对平衡的影响可归纳为下表 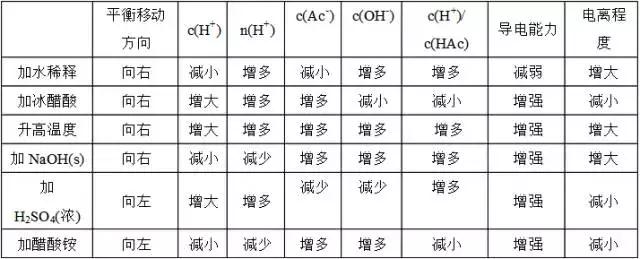 (责任编辑:admin) |