高二化学下册期末复习,选修4化学反应速率与化学平衡知识点总结
http://www.newdu.com 2025/12/01 12:12:25 三好网 佚名 参加讨论
期末考如期而至,但不少学生感觉如临大敌,谈考色变!不知你是否也中枪了?下面小编给大家带来的高二化学选修4第二章化学反应速率与化学平衡知识点总结,一起来看吧!  考点1:化学反应速率 1、化学反应速率的表示方法___________。 化学反应速率通常用单位时间内反应物浓度和生成物浓度的变化来表示。表达式:___________。 其常用的单位是__________、或__________。 2、影响化学反应速率的因素 1)内因(主要因素) 反应物本身的性质。 2)外因(其他条件不变,只改变一个条件)  3、理论解释——有效碰撞理论 (1)活化分子、活化能、有效碰撞 ①活化分子:能够发生有效碰撞的分子。 ②活化能:如图  图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2。(注:E2为逆反应的活化能) ③有效碰撞:活化分子之间能够引发化学反应的碰撞。 (2)活化分子、有效碰撞与反应速率的关系  考点2:化学平衡 1、化学平衡状态:一定条件(恒温、恒容或恒压)下的可逆反应里,正反应和逆反应的速率相等,反应混合物(包括反应物和生成物)中各组分的浓度保持不变的状态。 2、化学平衡状态的特征  3、判断化学平衡状态的依据  考点3:化学平衡的移动 1、概念 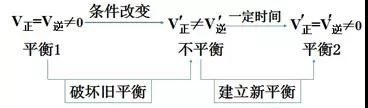 可逆反应中旧化学平衡的破坏、新化学平衡的建立,由原平衡状态向新化学平衡状态的转化过程,称为化学平衡的移动。 2、化学平衡移动与化学反应速率的关系 (1)v正>v逆:平衡向正反应方向移动。 (2)v正=v逆:反应达到平衡状态,不发生平衡移动。 (3)v正<v逆:平衡向<span>逆反应方向移动。 3、影响化学平衡的因素 4、“惰性气体”对化学平衡的影响 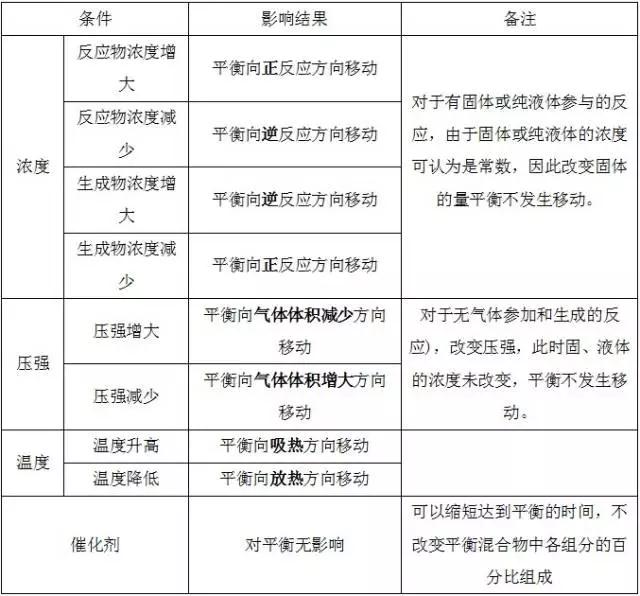  (责任编辑:admin) |