对2008年四川理综第27题的探讨
http://www.newdu.com 2025/12/02 02:12:56 人民教育出版社 佚名 参加讨论
对2008年四川理综第27题的探讨 江苏省南京市金陵中学 王海富 题目:A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1:2。在一定条件下,各物质之间的相互转化关系如右图(图中部分产物未列出)。 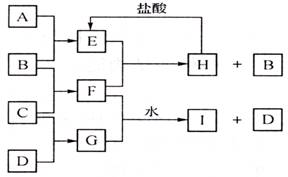 请填写下列空白:(1)、(2)、(3)略 (4)F与G的水溶液反应生成I和D的离子方程式是 。 答案:S2-+Na2O2+ 2H2O ===4OH-+S↓+2Na+ 现笔者对该小题及答案有两点看法,在这里和大家探讨下。 1.由题意推得D为S,F为Na2O2,G为Na2S,根据电子得失守恒,1 mol S2-被氧化成S需1 mol Na2O2。如果Na2O2超过1 mol,将和水反应生成O2。题目没有明确Na2S和Na2O2的比值,部分产物未列出。如果没O2生成,Na2S和Na2O2按等物质的量在水中反应生成S和NaOH,离子方程式同答案;如果有O2生成而没列出,Na2S、Na2O2和水反应的离子方程式将不唯一,相当于两个平行反应的叠加。 S2-+Na2O2+ 2H2O ===4OH-+S↓+2Na+ ① 2Na2O2+ 2H2O ===4OH-+ O2↑+4Na+ ② 将(1)×a + (2) ×b处理得, a S2-+(a+2b)Na2O2+ 2(a+b)H2O = 4(a+b)OH-+aS↓+b O2↑+2(a+2b)Na+ ③ 本题反应物的比值和关键产物都不明确,原答案仅是③的特例。 2.向新配制的Na2S溶液中加入Na2O2。随着Na2O2的加入,没有观察到S沉淀生成。 S能溶于热NaOH溶液,生成Na2S和Na2SO3。Na2S和Na2O2在水中反应生成NaOH并放出大量的热,符合S溶解的条件。 3S+6OH- 向部分反应液中加入稀硫酸,溶液很快变成乳白色的浊液。Na2SO3和未反应完的Na2S在酸性条件下反应生成S。 2S2-+SO32-+ 6H+===3S↓+3H2O S2-在一定条件下能被Na2O2氧化成SO32- S2-+3Na2O2+3H2O ===6OH-+SO32-+6Na+ 向剩余的反应液中继续加入过量的Na2O2(可能会析出白色固体NaOH),反应后分成2份。一份加入稀盐酸,几乎没有S生成;另一份加入盐酸酸化的BaCl2溶液,立即生成了白色沉淀。说明中间产物SO32-被氧化成SO42-。 S2-+4Na2O2+ 4H2O ===8OH-+ SO42-+8Na+ 上述实验证明S和热NaOH溶液的确发生了后续反应。S2-被Na2O2氧化成SO32-或SO42-。原题答案中产物为S和NaOH,显然没考虑反应物的量和反应温度升高对实际反应的影响。 以上是个人的两点看法,希望和各位老师探讨,以期抛砖引玉。 (责任编辑:admin) |
- 上一篇:高考有机化学常见题型归类分析
- 下一篇:时政热点聚焦2008高考化学