化学计量在实验中的应用(第一课时学案)
http://www.newdu.com 2025/12/23 05:12:16 人民教育出版社 佚名 参加讨论
化学计量在实验中的应用(第一课时学案) 【学习目标】 了解物质的量及其单位摩尔 了解阿伏伽德罗常数的含义 掌握物质的量与微粒数目、物质的量与质量之间的有关计算 掌握摩尔质量及其表示方法 【目标一】物质的量及其单位——摩尔 1.物质的量的概念:物质的量是表示含有一定数目粒子的集合体的物理量。 ①“物质的量”是一个物理量的整体名词,跟“长度”、“质量”、“时间”、“电流”一样“物质的量”四个字不能简化或增添任何字,更不能按字面意义把物质的量与物质的质量或数量混淆。 ② 物质的量是计量微观粒子的物理量。“微观粒子”可以是分子、原子、离子、中子或质子等单一粒子,也可以是这些粒子的特定组合。 ③ 物质的量用符号“n”表示。 2.摩尔: ① 定义:摩尔是 的单位。简称 ,符号 。 ② 基准:科学上规定以 所含的碳原子个数,作为摩尔的基准。 如果一定量的粒子集合体中所含有的 与 所含有的碳原子数相同,我们就说它为 。 ③ 1mol任何粒子的粒子数叫做 常数。阿伏加德罗常数的符号为NA, 通常使用6.02×1023 mol—1这个近似值。每摩尔物质约含有 个微粒。 3.物质的量(n)、阿伏加德罗常数(NA)与粒子数(N)之间的关系为 n = 【强调】①注意6.02×1023 mol—1与NA的区别。 ②粒子的数目之比等于其物质的量之比 【目标二】物质的量的表示形式:a mol(具体微粒的化学符号) 【练习】1molO、1molH2O、0.5molH+ 、3.5molH2SO4。说出它们表示的意义 【强调】① 物质的量表示原子、分子、离子、质子、中子、电子等微观粒子,不能描述宏观物质, 如1mol鸡蛋,这样说是错误的。 ② 表示的微粒要具体,指明粒子的种类用化学式。如0.5molO、1molH2、2molNa+ 等。如1 mol氢、1mol氧等是错误的。 【目标三】摩尔质量 1mol任何物质都约含有6.02×1023个粒子,但由于不同粒子的质量不同,因此,1mol不同物质的质量也不同,那么,这1mol物质的质量到底多大?怎样计算1mol物质的质量呢? 1.推算1mol原子、分子、离子的质量。 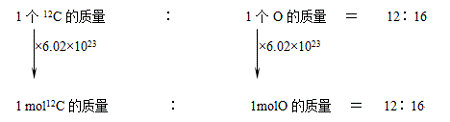 知道1mol12C的质量为12克,那么1molO的质量为 克 同理,可以推出1 mol其它原子、分子、离子的质量。 通过以上分析,我们不难看出:1 mol任何粒子或物质的质量以 为单位,在数值上等于 。 2.摩尔质量 ⑴ 定义:单位 叫该物质的摩尔质量。 ⑵ 符号为“M” ,单位为 ⑶ 数学表达式:M= ⑷ 数值关系:当物质的摩尔质量以g/mol为单位时,在数值上等于其 例如:O2的摩尔质量是32g/mol,H2SO4的摩尔质量是98g/mol,SO42-的摩尔质量是96g/mol。 注意区别下列说法: a. 1mol H2O的质量为18g b. H2O的摩尔质量为18g/mol 3.物质的量(n)、物质的质量(m)和物质的摩尔质量(M)之间的关系为: M = m = n = 【课堂练习】 1.判断下列说法是否正确: ⑴ 每摩尔物质约含有6.02×1023个粒子。( ) ⑵ 摩尔是七个物理量之一。( ) ⑶ 摩尔是物质的质量单位。( ) ⑷ 摩尔是物质的数量单位。( ) ⑸ 1mol小麦约含有6.02×1023个麦粒。( ) 2.填空: ⑴ 3mol H2SO4中约含有 个H2SO4, 个O。 ⑵ 1mol H2O中约含有 个H2O, 个H, 个O。 ⑶ 1.204×1024个H2O的物质的量为 。 ⑷ 0.5mol Na2SO4含有 molNa+, mol SO42-, molO。 3.填空: ⑴ 36gH2O中约含有 个H2O, 个H, 个O, mol H, mol O, mol e- ⑵ 49g H2SO4溶于水能电离出 个H+、 个SO42- ⑶ 1mol Na在化学反应中失去 个e- ⑷ 1mol H+被还原成单质需得到 个e- ⑸ 24.5g H2SO4的物质的量是 ⑹ 71g Na2SO4中含有Na+和SO42-的物质的量各是多少? (责任编辑:admin) |