高中化学必修1期末综合测试卷(二)
http://www.newdu.com 2025/12/02 07:12:34 人民教育出版社 佚名 参加讨论
高中化学必修1期末综合测试卷(二) 四川省江油中学化学组 杨艳丽 庞春会 可能用到的元素的相对原子质量:H 1;C 12;O 16;Na 23;Al 27;Cl 35.5;S 32 第I 卷(选择题 共50分) 一、选择题(本大题包括25小题,每小题2分,共50分,每小题只有1个选项符合题意) 1.金属的使用是人类 A.金属的活泼性强弱 B.金属 C.金属在地壳中的含量多少 D.金属的导电性强弱 2.下列关于合金的说法不正确的是 A.硬铝比纯铝的硬度低 B.合金中可以含有非金属元素 C.青铜是一种铜锡合金 D.高碳钢的熔点比纯铁低 3.下列有关硅元素的叙述中,正确的是 A.硅可用于制备光导纤维 B. C. 4.下列试剂中,能用带玻璃塞的试剂瓶贮存的是 A.盐酸 B.氢氧化钠溶液 C.氢氟酸 D.水玻璃 5.下列物质露置在空气中,质量会减轻的是 A.NaOH B.Na 2O2 C. CaO D.Na2CO3·10H2O 6.随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品氧化变质,在包装袋中可以放入的化学物质是 A.无水硫酸铜 B.硫酸亚铁 C. 食盐 D. 生石灰 7.将Fe、Cu、FeCl2、FeCl3、CuCl2的固体混合物和盐酸盛于同一容器中,充分反应后有固体剩余,若再滴入几滴稀盐酸会有气泡出现,则原混合物反应后存在于容器中的物质有 A.Cu、FeCl3、HCl B.FeCl2、FeCl3、HCl C.Cu、CuCl2、Fe D.Cu、FeCl2、Fe 8.下列有关物质的性质与应用不相对应的是 A.Na2O2能与水和二氧化碳反应生成氧气,可用于呼吸面具中作为氧气的来源 B.铝的熔点很高,可用于制作耐高温材料 C.明矾能在天然水中生成Al(OH)3 D.Na、Ba等金属化合物焰色反应呈现各种艳丽色彩,可制成节日烟花 9.有甲、乙两个完全相同的密闭装置,分 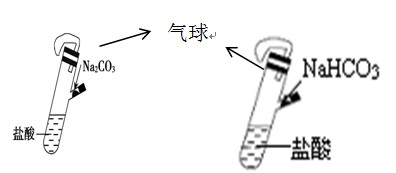 A.甲装置的气球膨胀得快 B.若最终两气球体积不同,则一定有c(HCl)≤1 mol C.若最终两气球体积相同,则一定有 c(HCl D.最终两溶液中Na 10.向100 mL 0.5 mol· L-1AlCl3溶液中加入金属钠,完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是 A.2.3 g B.3.45 g C.4.6 g D.1.15 g 11.在下列各溶液中,离子一定能大量共存的是: A.强碱性溶液中:K+、Al3+、Cl-、SO42- B.加入铝粉放出大量H2的溶液中:Na+、Ba2+、HCO3-、NO3- C.含有1.0mol·L-1 H +的溶液中:Fe 2+、K+、Cl-、NO3- D.滴加石蕊试液显红色的溶液::K+、Mg2+、Cl-、NO3- 12.下列离子方程式书写正确的是 A.FeCl2溶液中滴入氯水:2Fe2++Cl2====2Fe3++2Cl- B.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑ C.Ba(OH)2溶液与稀硫酸的反应:OH-+H+====H2O D.AlCl3溶液中加入过量氨水:Al3++4OH-==== 13.X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的转化关系,下列说法正确的是 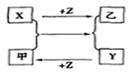 A.X、Y、Z中至少有一种是金属单质 B.X、Y、Z一定都是非金属单质 C.如果X、Y都为非金属单质,则Z必为金属单质 D.如果X是金属,则Y可能是非金属;如果X是非金属,则Y也可能是金属 14.在盛有碘水的试管中,加入适量CCl4后充分振荡,静置片刻后 A.整个溶液变紫色 B.整个溶液变为棕黄色 C.上层为无色,下层为紫红色 D.下层无色,上层紫红色 15.用NA表示阿伏加德罗常数的数值,则下列说法中不正确的是 A.常温常压下,18g H2O所含质子数为10NA B.常温常压下,11.2L氧气含原子数为NA C.2.3g金属钠变为钠离子得到0.1NA电子 D.常温常压下,NA个氢分子的质量为2g 16.下列反应中属于氧化还原反应,又是离子反应的是 ( ) A、铁和稀硫酸反应 B、碳和氧化铁高温反应 C、电解水 D、氢氧化亚铁与盐酸反应 17. 只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、五种溶液, 该试剂是( ) A.BaCI2 B.H2SO4 C.NaOH D.AgNO3 18.关于同温同压下等体积CO2和CO的叙述:①质量相等 ②密度相等 ③所含分子数相等 ④所含碳原子数相等。 其中正确的是 A.①②③④ B.②③④ C.③④ D.③ 19.下列化学变化中需加入氧化剂才能实现的是 A.Fe→FeCl2 B.SO3→H2SO4 C.CO2→CO D.KMnO4→MnCl2 20.下列物质在空气中久置会发生变质,且在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是 A.苛性钠溶液 B.漂白粉 C.氯水 D.生石灰 21.用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是C A.1:3:3 B.1:2:3 C.3:2:2 D.3:1:1 22.下列除杂方案中,括号内为除去杂质所需的药品,其中正确的是 A.NaOH溶液中混有Ba(OH)2 [K2SO4 ] B.Cu(NO3)2溶液中混有AgNO3 [Cu粉] C.CO2中混有CO [炽热的炭] D.CO2中混有HCl气体 [NaOH溶液] 23.下列各步变化:A[HCl]→B[Cl2]→C[Ca(ClO)2]→D[HClO]→E[CO2],其中不能直接实现的是 A.A→B B.B→C C.C→D D.D→E 24.下列物质的溶液能导电,但不属于电解质的是( )。 A、Ba(OH)2 B、CH4 C、Cl2 D、HCl 25.下列离子方程式中书写正确的是( )。 A、FeCl2溶液中通入Cl2 Fe2+ + Cl2 === Fe3+ + 2Cl- B、Al2O3与NaOH溶液反应 Al2O3 + 2OH- ===2[ Al(OH)4]- C、FeCl3溶液与铜 Fe3+ + Cu === Fe2+ + Cu2+ D、用醋酸除水垢 2CH3COOH + CaCO3 ===2CH3COO- + Ca2+ + H2O + CO2 第Ⅱ卷(非选择题 共50分) 二、填空题(本题包括3小题,共22分。) 26.(6分)A、B、C、D、F五种物质的焰色反应均 (1)写出F和H反应的化学方程式: 。 (2)写出下列反应的离子方程式:①B+水 。 ②D溶液+足量氢氧化钡溶液 。 27.(8分)已知下列物质的相互转化关系。试回答有关问题: 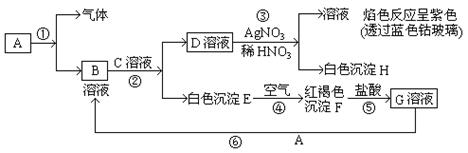 (1)上述转化关系中属于复分解反应的是 (填有关序号);(2)写出由E转变成F的化学方程式 ;(3)写出检验B溶液中阳离子的实验操作 ; (4)写出G溶液与KI溶液反应的离子反应方程式 。 28.(8分)铝土矿的主要成分是 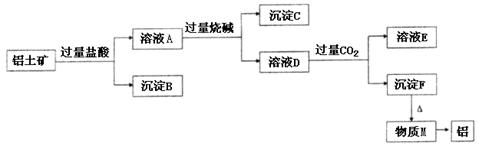 请回答下列问题:(1)高温下B与焦炭反应的化学方程式为___________ ___; (2)沉淀C的成分是_____ _______,溶液D中存在较多的阴离子是______________; (3)沉淀F转化为物质M的化学方程式为________________________________________; (4)F溶于烧碱溶液反应的离子方程式为__________________________________________ 三、实验题(本题包括2小题,共18分。) 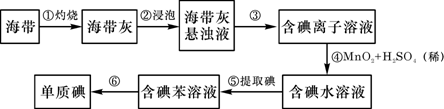 29.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: 请填写下列空白:(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处) 。 A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器 (2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。 (3)步骤⑤中,某学生选择用苯来提取碘的理由是 。 (4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。 30.(10分)某同学欲探究 (2)通过上述实验证明溶液中确实存在 (4)已知溶液X可使酸性 四、计算(本大题包括1小题,共10分。) 31.取100 mLNa2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液,再加过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。计算(要写出计算步骤): ⑴原混合液Na2SO4的物质的量浓度。⑵产生的气体在标准状况下的体积。 高中化学必修1期末综合测试卷(二)参考答案 选择题
26. (1)2 Na2O2+2CO2=2Na2CO3+O2 2Na+2H2O=2Na++2OH-+H2↑ HCO3-+OH-+Ba2+ =Ba CO3↓ +H2O 27.(1) ②③⑤ (2)4Fe(OH)2+O2+2H2O=4Fe(OH)3 (3)取少量B溶液于试管中,先滴加少量KSCN溶液,无现象,再滴加氯水,溶液变成血红色, 说明溶液中含Fe2+离子 (4)2Fe3++2I- 28.(1)SiO2+2CSi+2CO↑ (2) (3) 29.(1)BDE (2)过滤 蒸馏 (3)苯与水互不相溶;碘在苯中的溶解度比在水中大;苯与碘不发生化学反应 (4)取少量提取碘后的水溶液于试管中,加入几滴淀粉试液;观察是否出现蓝色(如果变蓝,说明还有单质碘) 30 (2)无色溶液先变红,后褪色。 (3) (4) 2 31.解:由题意可知m(BaSO4)= 4.66g n(BaSO4)= 0.02mol,(1分) 则m(BaCO3)= 14.51g—4.66g=9.85g n(BaCO3)= 0.05mol,(1分)再由化学方程式: Na2SO4+Ba(OH)2 = BaSO4↓+2NaOH 1 1 n(Na2SO4) 0.02mol (1分) BaCO3+2HNO3= Ba(NO3)2+H2O+CO2↑ 1 1 0.05mol n(CO2)(1分) 可求⑴c(Na2SO4)= n(Na2SO4)/V=0.2 mol·L-1 (2分) ⑵V(CO2)= 1.12L(1分) (责任编辑:admin) |
- 上一篇:《化学物质及其变化》单元检测题
- 下一篇:离子反应(1)