化学计量在实验中的应用——物质的量浓度(二)
http://www.newdu.com 2025/12/02 01:12:19 人民教育出版社 佚名 参加讨论
化学计量在实验中的应用——物质的量浓度(二) 河北衡水市第二中学 薛 杰 考查范围(物质的量浓度及其配制) 1.实验室配制1mol·L-1盐酸250mL,下列不需用的仪器是: ( ) A.250容量瓶 B.托盘天平 C.胶头滴管 D.烧杯 2.0.5 L AlCl3溶液中Cl-为9.03×1022个,则AlCl3溶液的物质的量浓度为 ( ) A.0.1 mol·L-1 B.1 mol·L-1 C.3 mol·L-1 D.1.5 mol·L-1 3.将a%的酒精和(100-a)%的乙醇溶液等体积混和后所得乙醇溶液的质量分数可能为 ( ) A.大于50% B.小于50% C.小于或等于50% D.大于或等于50% 4.将30mL 0.5mol/L NaCl溶液加水稀释到500mL,稀释后溶液中NaCl的物质的量浓度为( ) A.0.03mol/L B.0.3mol/L C.0.05mol/L D. 0.04mol/L 5.相同体积的NaCl溶液(浓度为C1)和Na2SO4溶液(浓度为C2),若其中的Na+ 物质的量浓度相同,则它们的物质的量浓度C1和C2的关系是( ) A.C1 =C2 B.C1 >C2 C.C1 <C2 D.2 C1 =C2 6.将标准状况下的a L HCl(气)溶于1000g水中,得到的盐酸密度为b g/cm3,则该盐酸的物质的量浓度是( ) A. 7.配制一定体积、一定物质的量浓度的溶液,下列情况对实验结果产生偏低影响的是( ) A.容量瓶中原有少量蒸馏水 B.溶解所用的烧杯未洗涤 C.定容时仰视观察液面 D.定容时俯视观察液面 8.完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中Cl﹣,消耗同物质的量浓度的AgNO3溶液的体积比为3:2:1,则上述溶液的体积比为( ) A.6:3:2 B.1:1:1 C.9:3:1 D.3:2:1 9.将12mol/L的盐酸(ρ=1.19g/cm3)50mL稀释成6mol/L的盐酸(ρ=1.10g/cm3),需加水的体积为( ) A.50mL B.50.5mL C.55mL D.59.5mL 10.NA为阿伏加德罗常数,下列对0.3mol/L的K2SO4溶液的说法中,正确的是( ) A. 1L溶液中含0.3NA个钾离子 B. 1L溶液中含0.9NA个离子(K+、SO42-) C. 2L溶液中钾离子浓度是1.2mol/L D. 2L溶液中含0.6 NA个离子(K+、SO42-) 11.把5%的Na2CO3溶液蒸发掉64.3g水后,溶液变为31mL,浓度变为14%,则浓缩后 Na2CO3 溶液的物质的量浓度为( ) A.8.52mol/L B.4.26mol/L C.1.52mol/L D.3.04mol/L 12.14.2g98%的浓H2SO4密度为1.84g/cm3与10mL 18.4mol/L H2SO4的浓度相比( ) A.是同一浓度的不同表示方法 B.数值不同,也能换算为相同值 C.不同浓度的两种H2SO4溶液 D.无法比较其大小 13.有一未知浓度的盐酸溶液 25mL,在加入 0.5 mol·L-1 AgNO3溶液 25 mL后,改加 NaOH溶液,结果用去 0.1 mol·L-1NaOH溶液25mL,恰好完全中和,则盐酸的物质的量浓度为 ( ) A.0.2 mol·L-1 B.0.5 mol·L-1 C.0.1 mol·L-1 D.0.25 mol·L-1 14.从1mol/LNaOH溶液2L中取出100mL,有关这100mL溶液的叙述中不正确的是 ( ) A.物质的量浓度为0.1mol/L B.物质的量浓度为1mol/L C.含NaOH 40g D.含NaOH 0.1mol 15.将7.45g氯化钾和11.1g氯化钙组成的混合物溶于水配成200mL溶液,此溶液中Cl-离子的物质的量浓度是 ( ) A.3mol/L B.1.5mol/L C.0.3mol/L D.0.2mol/L 16.某结晶水合物的化学式为R·xH2O其相对分子质量为M,在25℃时a g晶体溶于b g水中,既达饱和,形成V mL溶液,则下列表达式中不正确的是( ) A.饱和溶液的物质的量浓度100a(M-18x)/(MV) B.饱和溶液的密度(a+b)/V C.25℃,R的溶解度100a(M-18x)/(bM+18ax) D.饱和溶液的质量分数a(M-18x)/(a+b)M 17.用密度为ρ1g/cm3,质量分数是ω的浓盐酸,配制成体积比为1:4的稀盐酸,密度为ρ2g/cm3,则所配制稀盐酸的物质的量浓度为(mol/L)( ) A.1000ρ1ω/182.5 B.1000ρ1ρ2ω/(ρ1+4) C.1000ρ1ρ2ω/36.5(ρ1+4) D.1000ρ1ρ2ω/182.5 18.配制 1 mol/L的CuSO4溶液500mL:,需胆矾 g;用 称出,把称好的胆矾放入 里,用适量蒸馏水使它完全溶解,把制得的溶液小心地中,用适量蒸馏水洗涤烧杯 2~3次,把每次的洗涤液都注入 中,然后慢慢地加入蒸馏水到液面在刻度线下 ,改用 滴加蒸馏水到刻度,使溶液的 最低点正好与刻度线 ;把瓶塞盖好,用 顶住瓶塞,另一只手 ,将瓶底倒转、摇匀。从配好的溶液中取出10mL,此时溶液的物质的量浓度为 。 19.(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图3—2所示的游码尺上画出游码的位置(画“|”表示)。
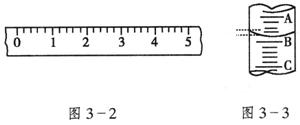 (2)图3—3表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中的液体的体积是__________mL。 (3)配制 20.某学生用已知质量yg的表面皿,准确称取w g NaOH固体。他在托盘天平的右盘上放(w+y)g砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边(如右图所示),下面他的操作应该是 使 。 若称取的w g NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制500mol·L-1NaOH溶液过程示意图中有错误的是(填操作序号) 。 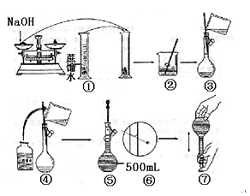 21.在配制物质的量浓度溶液时,下列操作出现的后果是(填:“溶液浓度不准确”、“偏低”、“偏高”、“无影响”): (1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体。_____________。 (2)配制氢氧化钠溶液时,溶液不能澄清,溶质少量不溶解。____________。 (3)配制氯化钠溶液时,容量瓶中有少量水。______________。 (4)定容时,液面上方与刻度相齐时,停止加水。__________。 (5)配制好溶液后,容量瓶未塞好,洒出一些溶液。_____________。 (6)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线________________。 22.在标准状况下,将一个充满HCl气体和氧气的集气瓶倒放于盛水的水槽中,水面上升至集气瓶容积的2/3。把集气瓶从水中取出(假设HCl全部留在集气瓶中),则集气瓶内溶液中的溶质的质量分数为_____________。若溶液密度的变化忽略不计,则HCl的物质的量浓度为_____________mol/L。 答案: 1-5:B;A;C;A;B;6-10:D;C;C;B;B;11-17:C;AB;C;AC;B;A;C 18.125g; 天平; 烧杯; 转移至容量瓶; 玻璃棒;容量瓶; 2—3;食指;托住瓶底;1mol/L 19.(1)下表为取用砝码情况,图3-(1)所示为游码尺上的游码位置。
 (2)3.2 (3)10mL量筒,200ml容量瓶,烧杯,玻棒,胶头滴管 20.继续加入样品 指针指在标尺的中间 ①③⑥; 21.(1)偏低 (2)偏低 (3)无影响 (4)偏高 (5)无影响 (6)偏低 22.1.63% 0.045 (责任编辑:admin) |
- 上一篇:必修1 第三章《重要的有机化合物》测试题
- 下一篇:《钠的化合物 》测试